
Une transformation physique intervient dès lors qu'un ensemble d'entités chimiques (atomes, molécules ou ions) est soumis à des variations de paramètres thermodynamiques comme la pression \(P\), la température \(T\) ou le volume \(V\). Ces variations de paramètres physiques engendrent des changements de comportement ou de phase (solide, liquide, gaz) de la matière. Ce chapitre de transformation de la matière va donc permettre de décrire une tranformation physique et de caractériser les grandeurs nécessaires à l'étude d'une transition de phase.
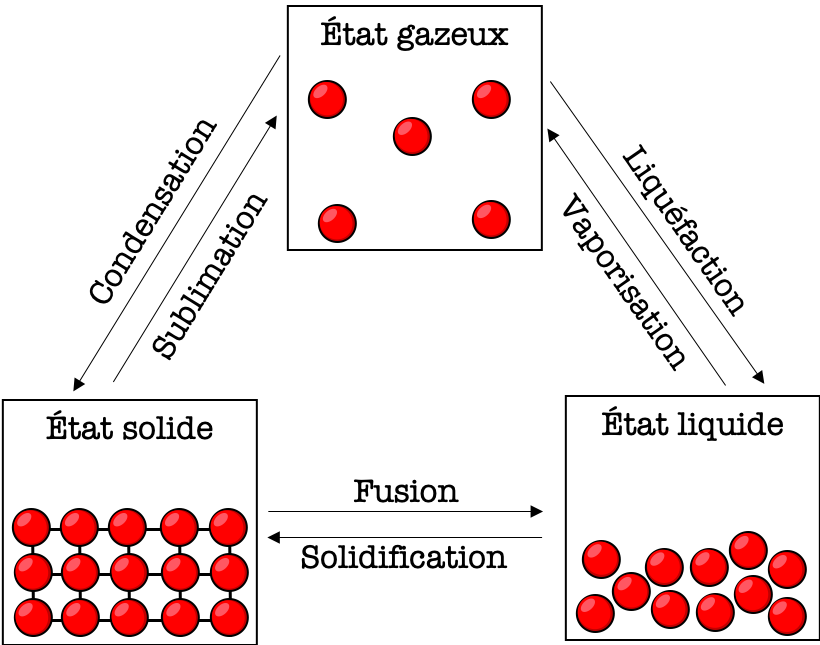
1. Le changement d'état du corps pur
1.1. Écriture symbolique d'un changement d'état
Une espèce chimique (notée \(A\)) passe de l'état solide (s) à l'état liquide (l).
Le changement d'état est représenté avec la notation suivante : $$\mathrm{\large A_{(s)}\longrightarrow A_{(l)}}$$
1.2. Modélisation microscopique d'un changement d'état
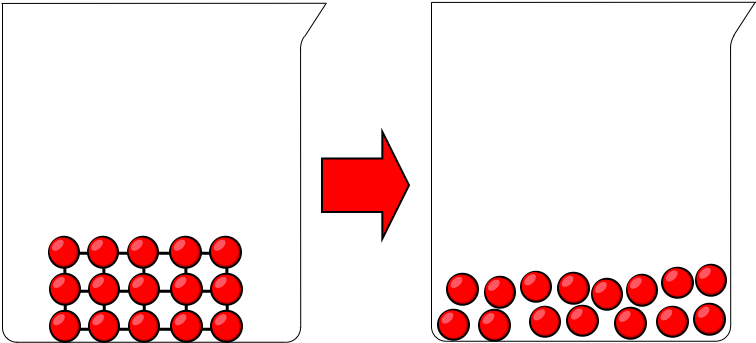
La matière peut être représentée microscopiquement par les entités (atomes, molécules ou ions) dont elle est constituée. Les trois phases de la matière sont représentées ci-dessous, ainsi que les noms des transformations physiques qui permettent de passer d'une phase à l'autre.
 |
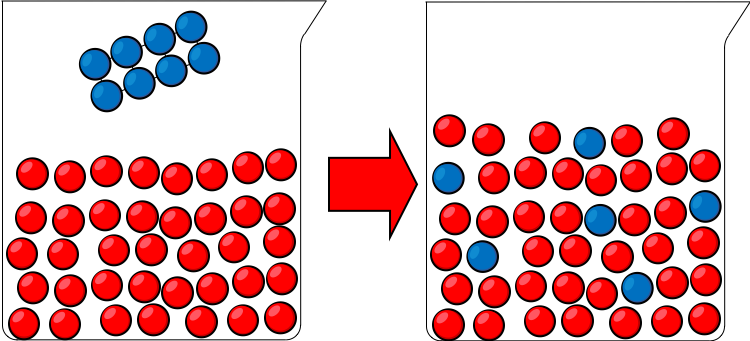 |
| (a) La fusion de la glace (\(\mathrm{H_2O_{(s)}}\)) | (b) La dissolution du sel (\(\mathrm{NaCl_{(s)}}\)) dans l'eau (\(\mathrm{H_2O_{(l)}}\)) |
2. La notion d'énergie
L'énergie \(\mathcal{E}\) est la grandeur physique qui permet de mesurer le changement d'état d'un système (forme, vitesse, température, etc).
Son unité dans le système international est le joule (J).
Cette énergie peut être stockée sous la forme :
- d'énergie thermique en augmentant la température d'un corps.
- d'énergie cinétique en mettant en mouvement un corps.
- d'énergie électromagnétique comme dans la lumière.
- d'énergie potentielle en comprimant, par exemple, un ressort.
- etc.
2.1. Transformation exothermique - transformation endothermique
Une transformation est dite endothermique si la variation d'énergie thermique au cours de la transformation est positive.
Une transformation est dite exothermique si la variation d'énergie thermique au cours de la transformation est négative.
Parmi les changements d'état du corps pur :
- La fusion, la sublimation et la vaporisation sont trois transformations physiques endothermiques. Il est nécessaire d'apporter de l'énergie thermique au système pour que celui-ci change de phase. En conséquence, la variation d'énergie thermique du système est positive.
- La condensation, la solidification et la liquéfaction sont trois transformations physiques exothermiques. En effet, le système rejette de l'énergie thermique dans son environnement au cours de la transformation. En conséquence, la variation d'énergie thermique du système est négative.
2.2. Énergie massique de changement d'état
L'énergie massique de changement d'état \(l\) (ou chaleur latente, ou enthalpie de changement d'état) est l'énergie algébrique nécessaire pour faire changer d'état \(1 \ \mathrm{kg}\) du corps considéré.
L'énergie massique de vaporisation de l'eau est de \(l_{vap}=2264\ \mathrm{J \cdot kg}\). C'est donc l'énergie que l'on doit apporter au système physique constitué d'un kilogramme d'eau liquide pour le faire changer d'état vers l'état gazeux. En conséquence, pour une masse \(m\) d'eau, on doit apporter une énergie \(\mathcal{E}\) qui vérifie la relation suivante : $$\Large \boxed{\mathcal{E}=m \times l_{vap}}$$ Ainsi, pour vaporiser \(m=2,00\ \mathrm{g}\) d'eau liquide, il est nécessaire d'apporter une énergie \(\mathcal{E}=2,00 \times 10^{-3} \times 2264 = 4,51 \ \mathrm{J} \).