
Contrairement à une transformation physique, une transformation chimique fait intervenir des espèces chimiques qui peuvent se transformer chimiquement au cours de la transformation. C'est-à-dire que ces espèces chimiques peuvent s'assembler ou se démanteler pour former de nouvelles molécules, voire échanger des électrons pour acquérir ou perdre une charge électrique. Le cours sur les transformations chimiques va donc permettre de comprendre les processus microscopiques qui entrent en jeu lors d'une réaction chimique, d'identifier les règles de conservation indispensables à la stabilité de la matière et enfin de décrire les phénomènes observés.
1. Modélisation macroscopique d'une transformation chimique
1.1. Le système chimique
Un système chimique est un volume de l'espace contenant un ensemble d'espèces chimiques susceptibles de réagir entre elles. On détermine l'état d'un système chimique en précisant :
- L'état physique de ses constituants (solide (s), liquide (l), gazeux (g) ou aqueux (aq)).
- Les paramètres physiques du système chimique (température T et pression P).
- L'ensemble des espèces chimiques présentes.
En \(1777\) le chimiste français Antoine Laurent de Lavoisier identifie la composition de l'air. Il effectue pour cela une transformation chimique entre un bain de mercure (\(\mathrm{Hg}\)) et de l'air, à la température ambiante \(T=25 \mathrm{^{\circ} C}\) et à pression atmosphérique \(P=1\ \mathrm{bar}\). L'air étant contitué à \(80\%\) de diazote (\(\mathrm{N_{2_{(g)}}}\)) et à \(20\%\) de dioxygène (\(\mathrm{O_{2_{(g)}}}\)), on peut représenter le système chimique par l'encadré ci-dessous.
 |
|
|||||
| (a) Antoine Lavoisier et Marie-Anne Pierrette Paulze. | (b) État du système chimique au début de l'expérience de Lavoisier |
1.2. États initial et final - transformation chimique
L'état initial d'une transformation chimique est l'état du système chimique (température, pression, composition chimique) avant la transformation chimique.
L'état final d'une transformation chimique est l'état du système chimique (température, pression, composition chimique) après que la transformation chimique a eu lieu.
Une transformation chimique correspond à l'évolution d'un système chimique entre un état initial et un état final. Des epsèces chimiques peuvent apparaître ou disparaître lors de la transformation.
Dans son expérience, Lavoisier observe le jour suivant des "petites parcelles rouges" solides à la surface du mercure : de l'oxyde de mercure \(\mathrm{HgO}\). Il observe également que le gaz contenu dans le matras ne permet plus la combustion d'une buchette incandescente, c'est-à-dire que le dioxygène a disparu. Les conditions de pression et de température sont restées identiques à celles de l'état initial.
|
|
||||||||||
| (a) État initial du système chimique | (b) État final du système chimique |
1.3. Notion d'espèce spectatrice
Une espèce spectatrice est une espèce qui fait partie du système chimique à l'état initial et qui ne réagit pas pendant la réaction chimique. On la retrouve donc inchangée dans l'état final.
Dans l'expérience de Lavoisier, le diazote (\(\mathrm{N_{2_{(g)}}}\)) est présent à l'état initial et ne participe pas à la réaction chimique. C'est donc une espèce spectatrice.
2. La réaction chimique : un modèle de la transformation chimique
Le nombre d'entités chimiques (atomes, ions ou molécules) dans un système chimique étant très grand (de l'ordre du nombre d'Avogadro, soit \(10^{23}\) entités), les transformations microscopiques qui peuvent avoir lieu au sein du système chimique relèvent de la physique statistique. On peut considérer que toutes les transformations imaginables ont lieu dans le système chimique. Néanmoins, certaines lois établies dans le cours de structure de la matière expliquent les propriétés de stabilité de certains édifices atomiques. Il y aura donc, dans un système chimique, des transformations qui seront plus probables car mettant en jeu des mécanismes et des édifices atomiques plus stables. La réaction chimique est une synthèse de toutes ces transformations possibles et ne retient que la transformation la plus probable et dont les conséquences seront les plus observables.
2.1. Écriture symbolique d'une réaction chimique
Les réactifs sont les espèces chimiques qui disparaissent au cours de la réaction chimique.
Les produits sont les espèces chimiques qui apparaissent au cours de la réaction chimique.
On représente donc une réaction chimique de la manière suivante : $$\large \mathrm{\underset{ÉTAT\ INITIAL}{\underbrace{Réactif\ n°1\ + Réactif\ n°2\ + ...}} \longrightarrow \underset{ÉTAT\ FINAL}{\underbrace{Produit\ n°1\ + Produit\ n°2\ +...}}}$$
La combustion du carbone (\(\mathrm{C}\)) avec le dioxygène (\(\mathrm{O_2}\)) de l'air produit du dioxyde de carbone (\(\mathrm{CO_2}\)). L'équation de la réaction chimique de combustion du carbone sera donc : $$\large \mathrm{C_{(s)}+O_{2_{(g)}}\longrightarrow CO_{2_{(g)}}}$$
2.2. "Rien ne se perd, rien ne se crée, tout se transforme" (A. Lavoisier)
- Le nombre total d'atomes, ainsi que le nombre d'atomes par type d'éléments chimiques. Cette condition revient en fait à conserver la masse de la matière au cours de la transformation.
- La charge électrique totale des réactifs. Les électrons n'existant pas de manière libre dans un milieu matériel, il sont soit partagés entre les atomes pour former des molécules, soit échangés entre atomes pour former des ions. Il est donc nécessaire que lors d'un échange, le nombre total d'électrons soit conservé.
La combustion du gaz méthane (\(\mathrm{CH_4}\)) dans le dioxygène (\(\mathrm{O_2}\)) de l'air conduit à la formation d'eau (\(\mathrm{H_2O}\)) et de dioxyde de carbone (\(\mathrm{CO_2}\)). En ne faisant réagir qu'une seule molécule de chaque espèce chimique, on peut écrire la réaction chimique suivante : $$\large \mathrm{CH_{4_{(g)}}+O_{2_{(g)}} \longrightarrow CO_{2_{(g)}}+ H_2O_{(g)}}$$ Néanmoins, si on fait un bilan de chaque atome rencontré à l'état initial et à l'état final, on obtient le tableau suivant :
| ATOME | ÉTAT INITIAL | ÉTAT FINAL |
|---|---|---|
| Carbone (\(\mathrm{C}\)) | 1 | 1 |
| Oxygène (\(\mathrm{O}\)) | 2 | 3 |
| Hydrogène (\(\mathrm{H}\)) | 4 | 2 |
| ATOME | ÉTAT INITIAL | ÉTAT FINAL |
|---|---|---|
| Carbone (\(\mathrm{C}\)) | \( {\color{red} 1}\times 1=1\) | \({\color{red} 1} \times 1=1\) |
| Oxygène (\(\mathrm{O}\)) | \({\color{red} 2} \times 2=4\) | \({\color{red} 1}\times 2+{\color{red} 2} \times 1=4\) |
| Hydrogène (\(\mathrm{H}\)) | \({\color{red} 4} \times 1=4\) | \({\color{red} 2} \times 2=4\) |
La corrosion du métal cuivre (\(\mathrm{Cu_{(s)}}\)) par l'ion oxonium (\(\mathrm{H_3O^{+}_{(aq)}}\)) contenu dans une solution aqueuse conduit à la formation d'ions (\(\mathrm{Cu^{2+}_{(aq)}}\)), d'eau (\(\mathrm{H_2O_{(aq)}}\)) et à un dégagement gazeux (\(\mathrm{H_2}\)). L'équation équilibrée de la réaction chimique est donc la suivante : $$\mathrm{{\color{red} 1}\ Cu_{(s)}+ {\color{red} 2}\ H_3O^{+}_{(aq)} \longrightarrow {\color{red} 1}\ \mathrm{Cu^{2+}_{(aq)}}+ {\color{red} 2}\ H_2O_{(aq)}+{\color{red} 1}\ H_{2_{(g)}}}$$
En répertoriant les atomes de chaque espèce chimique ainsi que les charges électriques totales dans un tableau, on obtient :| ATOME | ÉTAT INITIAL | ÉTAT FINAL |
|---|---|---|
| Cuivre (\(\mathrm{Cu}\)) | \( {\color{red} 1}\times 1=1\) | \({\color{red} 1} \times 1=1\) |
| Oxygène (\(\mathrm{O}\)) | \({\color{red} 2} \times 1=1\) | \({\color{red} 2}\times 1=2\) |
| Hydrogène (\(\mathrm{H}\)) | \({\color{red} 2} \times 3=6\) | \({\color{red} 2} \times 2+{\color{red} 1} \times 2=6\) |
| Charge électrique | \({\color{red} 2} \times (1+)=2+\) | \({\color{red} 1} \times (2+)=2+\) |
2.3. La notion de réactif limitant
Des réactifs sont en proportions stoechiométriques lorsqu'ils sont introduits dans le système chimique dans les proportions molaires des coefficients stoechiométriques. En d'autres termes, pour la réaction chimique suivante : $$\mathrm{{\color{red}a} \ A+{\color{red}b} \ B +{\color{red}c} \ C\longrightarrow {\color{red}d} \ D}$$ les réactifs A, B et C qui sont respectivement introduits dans le système chimique avec les quantités de matière \(\mathrm{n_A}\), \(\mathrm{n_B}\) et \(\mathrm{n_C}\) doivent vérifier les égalités suivantes : $$\large \mathrm{\boxed{\frac{n_A}{{\color{red}a}}=\frac{n_B}{{\color{red}b}}=\frac{n_C}{{\color{red}c}}}}$$
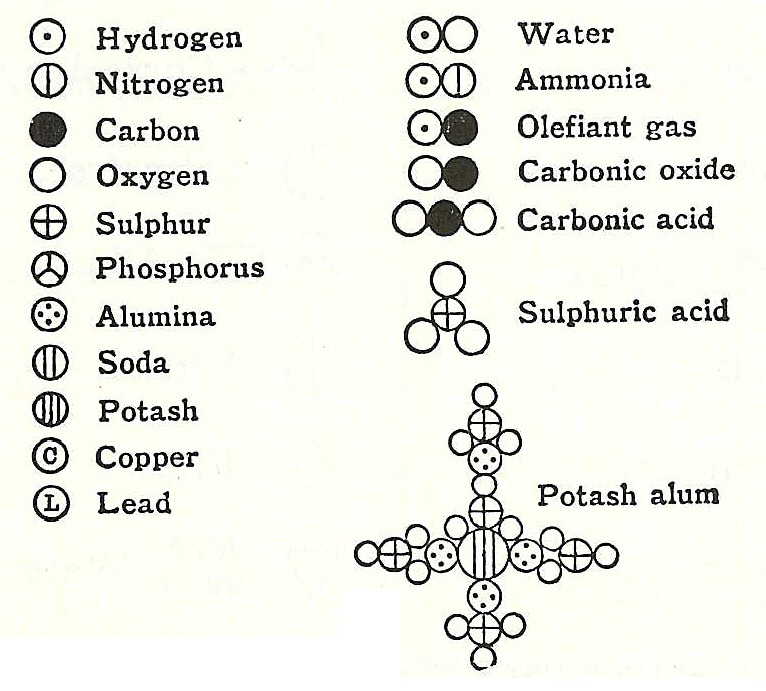
Figure 6 : Représentation des atomes par J. Dalton.
| \(\mathrm{{\color{red}1} N_{2_{(g)}}+{\color{red}1} O_{2_{(g)}} \longrightarrow {\color{red} 2} NO_{(g)}}\) | \(\mathrm{{\color{red}1} N_{2_{(g)}}+{\color{red}2} O_{2_{(g)}} \longrightarrow {\color{red} 2} NO_{2_{(g)}}}\) | \(\mathrm{{\color{red}2} N_{2_{(g)}}+{\color{red}1} O_{2_{(g)}} \longrightarrow {\color{red} 2} N_2O_{(g)}}\) |
| Formation du monoxyde d'azote | Formation du dioxyde d'azote | Formation du protoxyde d'azote |
| \(\mathrm{\boxed{\frac{n_{\mathrm{N_2}}}{{\color{red}1}}=\frac{n_{\mathrm{O_2}}}{{\color{red}1}}}}\) | \(\mathrm{\boxed{\frac{n_{\mathrm{N_2}}}{{\color{red}1}}=\frac{n_{\mathrm{O_2}}}{{\color{red}2}}}}\) | \(\mathrm{\boxed{\frac{n_{\mathrm{N_2}}}{{\color{red}2}}=\frac{n_{\mathrm{O_2}}}{{\color{red}1}}}}\) |
| Formation du monoxyde d'azote | Formation du dioxyde d'azote | Formation du protoxyde d'azote |
| \(\mathrm{n_{\mathrm{O_2}}=n_{\mathrm{N_2}}=1\ mol}\) | \(\mathrm{n_{\mathrm{O_2}}={\color{red} 2}n_{\mathrm{N_2}}=2\ mol}\) | \(\mathrm{n_{\mathrm{O_2}}=\frac{n_{\mathrm{N_2}}}{\color{red} 2}=0,5\ mol}\) |
| Formation du monoxyde d'azote | Formation du dioxyde d'azote | Formation du protoxyde d'azote |

Figure 7 : John Dalton.
|
|
||||||||||||||||||||
| (a) Masses des différents réactifs à l'état initial | (b) Rapport des masses entre les produits obtenus |
Si les réactifs ne sont pas introduits en proportions stoechiométriques, il existe un réactif limitant qui sera le premier réactif entièrement consommé et qui sera responsable de l'arrêt de la réaction. Les autres réactifs, qui ne sont pas entièrement consommés sont dits "en excès".
3. Les transformations chimiques exothermiques et endothermiques
3.1. Définitions
Une transformation chimique est dite "endothermique" lorsque la variation d'énergie thermique au cours de la transformation chimique est positive.
Une transformation chimique est dite "exothermique" lorsque la variation d'énergie thermique au cours de la transformation chimique est négative.
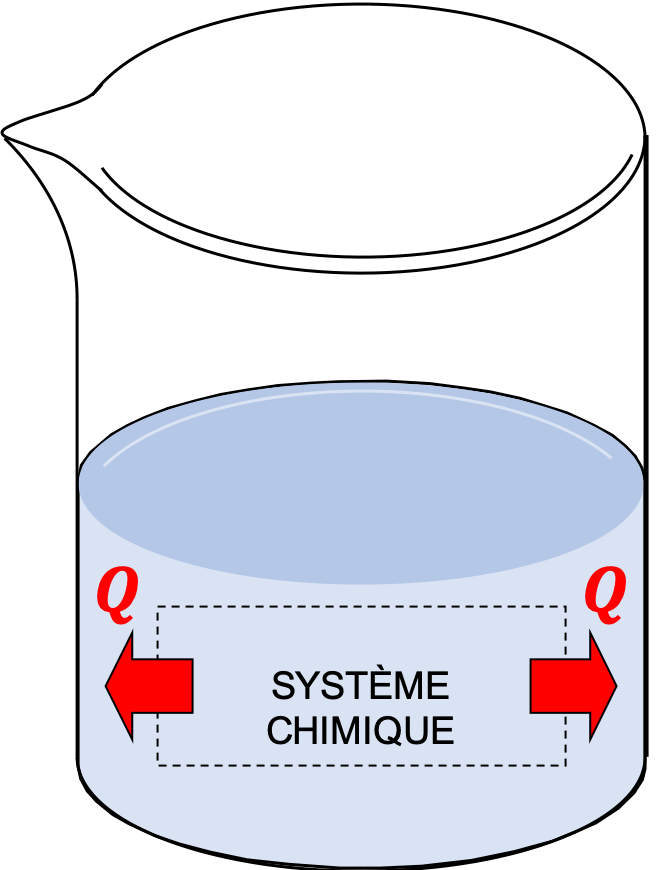
|
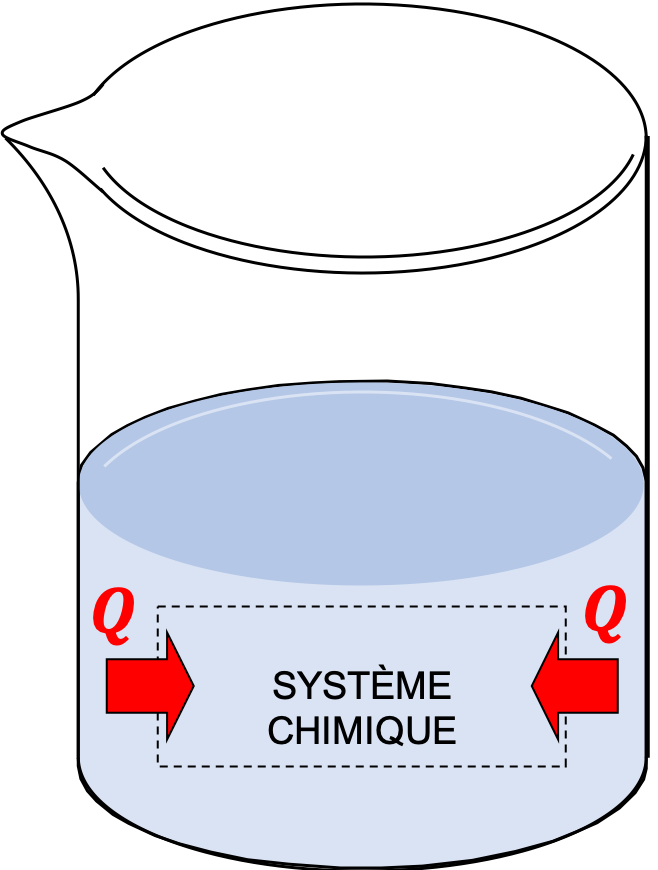
|
| (a) Transformation exothermique | (b) Transformation endothermique |
- Dans une transformation endothermique, la variation d'énergie thermique est positive. Par conséquent on a un apport d'énergie thermique (ou chaleur) qui se traduit par un sens de diffusion de l'énergie thermique vers l'intérieur du système chimique.
- Dans une transformation exothermique, la variation d'énergie thermique est négative. Par conséquent on a une perte d'énergie thermique (ou chaleur) qui se traduit par un sens de diffusion de l'énergie thermique vers l'extérieur du système chimique.
3.2. Influence sur la température du milieu réactionnel
Une réaction chimique faisant intervenir plusieurs espèces chimiques, il s'agit d'un mélange. Généralement, en activités expérimentales, on fait réagir les espèces chimiques étudiées dans un becher rempli d'eau. L'eau est alors le solvant qui est introduit dans le système chimique en large excès et qui ne participe pas (ou peu) à la réaction.
Il est donc plus judicieux de ne pas inclure le solvant dans le système chimique. Par conséquent, l'eau (solvant) constitue l'environnement immédiat du système chimique.
- Lors d'une réaction chimique exothermique dans un milieu aqueux, la chaleur dégagée par la réaction chimique vers l'eau contribue à augmenter la température du milieu.
- Lors d'une réaction chimique endothermique dans un milieu aqueux, la chaleur absorbée par la réaction chimique contribue à diminuer la température du milieu.