Le fait de comprendre comment se déroule une transformation chimique permet de prédire comment vont réagir des réactifs mis ensemble dans un milieu réactionnel. Pour synthétiser des molécules, il est donc nécessaire d'adopter une stratégie qui permet d'obtenir le produit souhaité en réduisant le surplus de réactifs, en évitant le rejet de vapeurs toxiques et en adaptant le dispositif expérimental pour la synthèse.
1. Synthétiser une molécule
Synthétiser une molécule, c'est la fabriquer à partir d'une réaction chimique.
Les molécules ainsi synthétisées peuvent être séparées en trois catégories suivant qu'on les trouve ou non dans la nature.
| LES MOLÉCULES NATURELLES | LES MOLÉCULES DE SYNTHÈSE | LES MOLÉCULES ARTIFICIELLES |
|---|---|---|
| Les molécules naturelles peuvent être directement trouvées dans la nature. | Les molécules de synthèse sont obtenues après une réaction chimique en laboratoire et sont une copie de molécules naturelles. Elles ont donc exactement les mêmes propriétés physico-chimiques que les molécules naturelles correspondantes. | Les molécules artificielles n'existent pas dans la nature et doivent obligatoirement être synthétisées en laboratoire. |
Figure 1 : Acétate de linalyle contenu dans la lavande.
2. Synthèse dans le montage à reflux
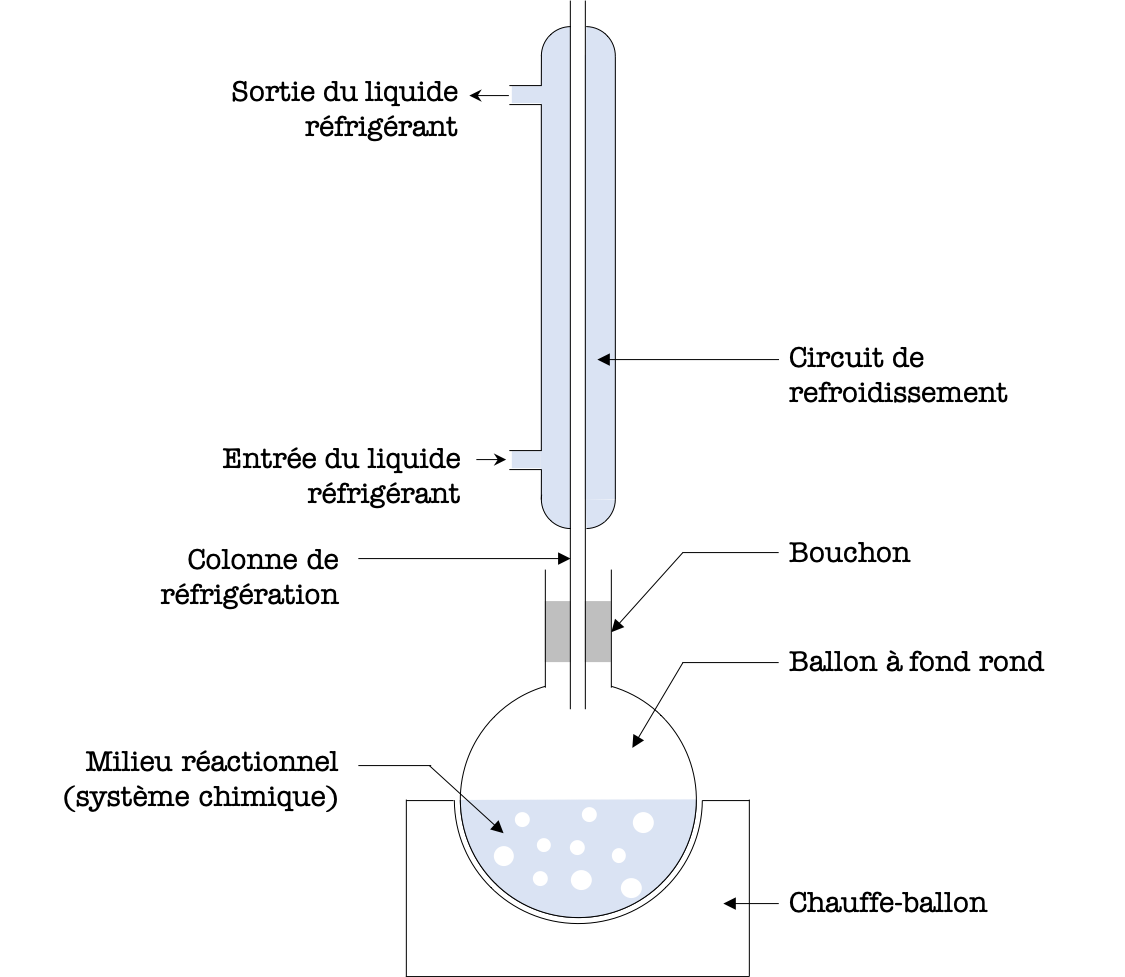
Lors de la synthèse d'une molécule, il est important de ne pas perdre de matière du fait des vapeurs dans le milieu réactionnel. Pour cela, on utilise un montage expérimental spécial : le montage à reflux (représenté sur la figure ci-dessous).
- Les réactifs sont introduits dans un ballon à fond rond qui est placé dans un chauffe-ballon (chauffage qui épouse la forme du ballon pour maximiser le transfert d'énergie thermique).
- Le mélange réactionnel est porté à haute température (voire à ébullition) de sorte que des vapeurs s'en dégagent.
- Un circuit de refroidissement faisant circuler de l'eau froide vient entourer la colonne de refroidissement et condense les vapeurs avant qu'elles ne puissent s'échapper par le haut de la colonne.
Il est important de ne pas boucher le haut de la colonne pour permettre un équilibrage de la pression \(P\) entre l'intérieur du ballon et l'environnement.
3. Extraction du produit de synthèse
Une fois le produit synthétisé, il est nécessaire de l'extraire des autres produits de la réaction chimique (on parle alors d'extraction). Pour cela, on peut utiliser les propriétés physico-chimiques des différents produits pour les séparer.
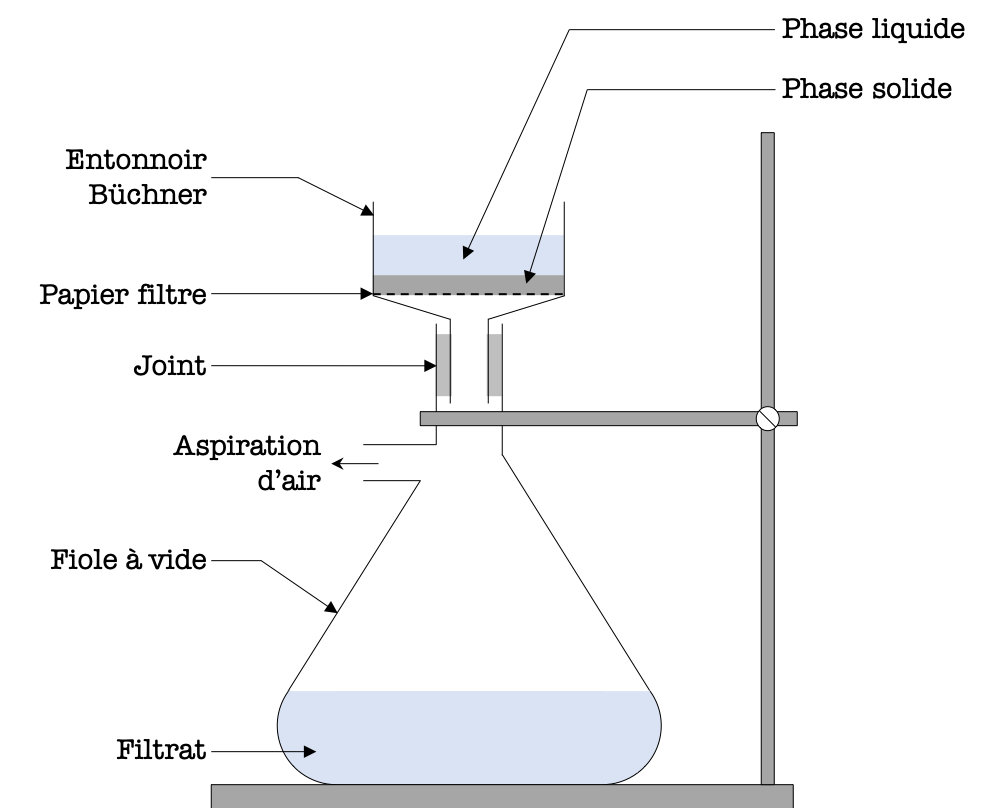
L'une des méthodes employée pour séparer deux produits de synthèse est l'entonnoir Büchner. Son emploi en tant qu'extracteur d'un produit de synthèse n'est possible que lorsque les produits de la réaction sont l'un solide et les autres liquides ou inversement.
- Si le produit de synthèse à extraire est solide, on parle d'essorage.
- Si le produit de synthèse à extraire est liquide, on parle de filtration.
Pour réaliser la séparation d'un produit de synthèse (solide) sur un montage Büchner, il est nécessaire de suivre dans l'ordre les étapes suivantes :
Figure 4 : Filtration sous vide.
- S'assurer que le montage est bien fixé à l'aide d'une potence, de pinces et de noix.
- Découper, installer et humidifier le papier filtre avec le liquide qui sera utilisé pour le lavage.
- Déposer le produit de la synthèse (solide et liquide) dans l'entonnoir Büchner en prenant garde à ne rien renverser.
- Verser du liquide de lavage (froid) et triturer le solide à l'aide d'une spatule.
- Mettre en fonctionnement la pompe à vide ou le robinet du lavabo puis fixer le tuyau d'aspiration de façon étanche sur la fiole à vide.
- Attendre quelques secondes que la dépression permette d'aspirer tout le liquide au niveau de l'entonnoir Büchner, puis casser le vide en retirant le tuyau d'aspiration.
Attention : il est nécessaire de "casser le vide" (c'est-à-dire déconnecter le tuyau d'aspiration) avant de couper l'aspiration provenant du lavabo pour éviter tout renvoi d'eau depuis le tuyau d'aspiration vers la fiole à vide.
- Recommencer éventuellement à partir de l'étape 4 pour faire plusieurs lavages du produit de synthèse.
- Récupérer toute la phase solide à l'aide d'une spatule et la mettre à l'étuve pour sécher le produit.
4. Analyse de la pureté à l'aide d'un échantillon
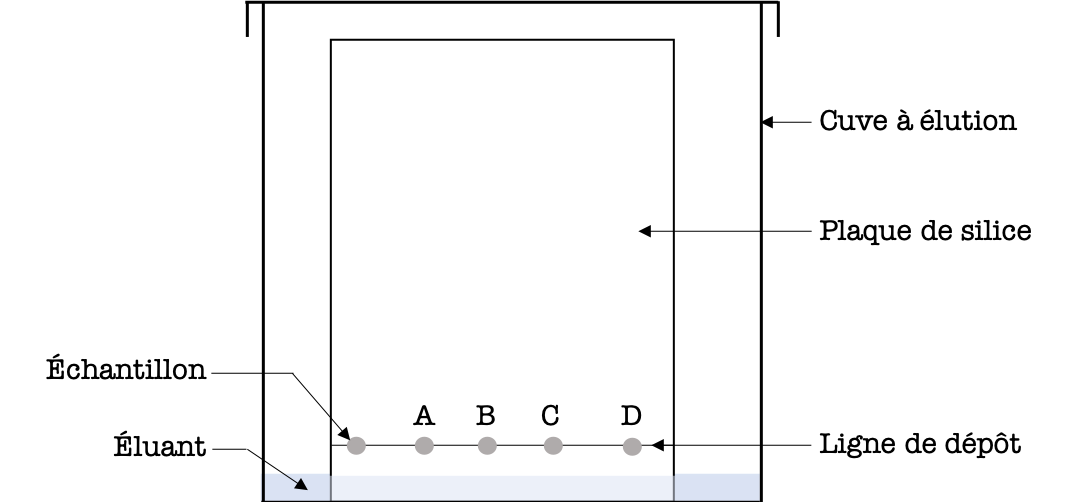
L'analyse d'un échantillon du produit de synthèse est une étape nécessaire pour analyser la pureté du produit obtenu. L'analyse mettra en évidence la présence de traces d'autres produits qui viendraient contaminer le produit de synthèse. L'une des méthodes d'analyse est la chromatographie sur couche mince (CCM).
Le principe de la CCM est résumé sur la figure ci-dessous.
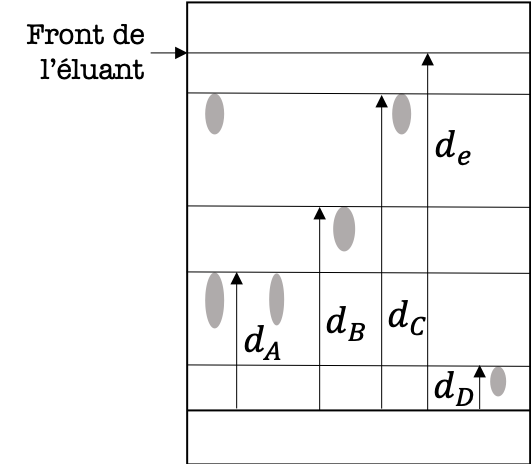
Figure 6 : Résultat de l'analyse par CCM.
- Lecture verticale
La lecture verticale permet de vérifier si l'échantillon du produit de synthèse est constitué d'un seul corps (corps pur) ou bien de plusieurs (mélange). Dans le cas d'un corps pur, on observera une seule tâche sur la plaque de silice, alors que dans le cas d'un mélange on observera plusieurs tâches.
Exemple :Dans le cas de la CCM réalisée sur la figure 6, l'échantillon s'est séparé en deux tâches. Il s'agit donc d'un mélange constitué de deux corps purs.
- Lecture horizontale
La lecture horizontale se fait en traçant le front de l'éluant au crayon à papier et en calculant les rapports frontaux de chaque dépôt effectué. Une espèce chimique aura parcouru la même distance quel que soit le dépôt dans lequel elle a été déposée. Un rapport frontal \(r_i\) se calcule de la façon suivante : $$ \boxed{r_i = \frac{\textrm{distance parcourue par l'espèce chimique "i"}}{\textrm{distance parcourue par l'éluant}}}$$
Exemple :Dans le cas de la CCM réalisée sur la figure 6, le rapport frontal de l'espèce chimique \(A\) s'écrit \(r_A=\frac{d_A}{d_e} \simeq 0,4\). On observe que l'espèce chimique \(A\) a parcouru exactement la même distance dans le dépôt de l'échantillon et celui du corps pur \(A\). On peut en conclure que l'échantillon analysé contient très probablement de l'espèce chimique \(A\).