1. Identification par les propriétés physiques
1.1. Température de changement d’état
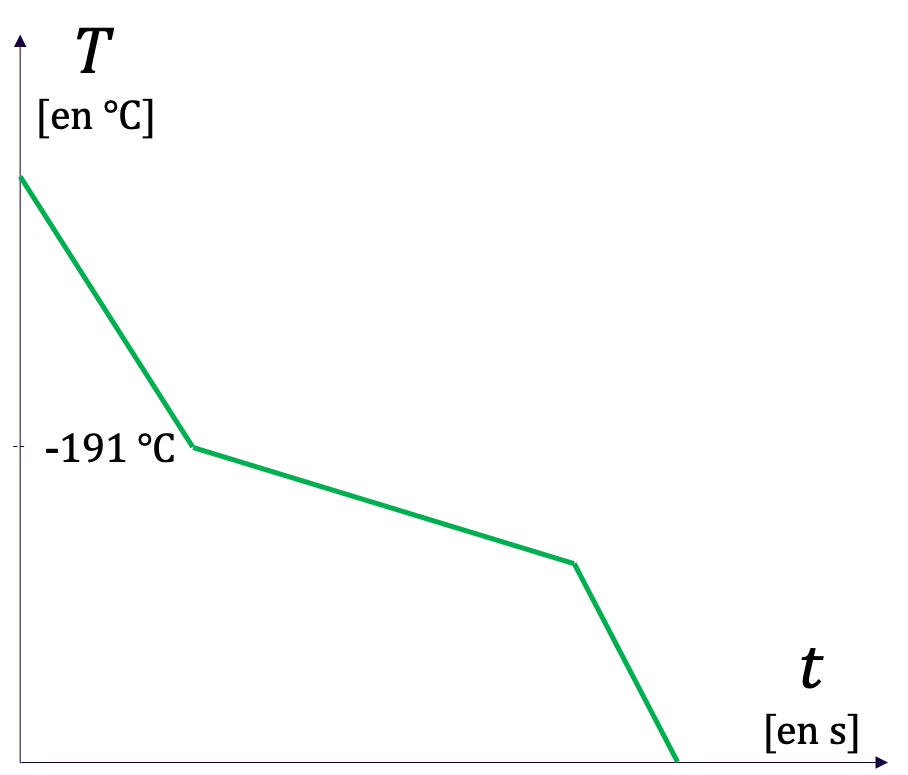
Une des méthodes d'identification d'espèces chimiques consiste à faire évoluer la température d'un échantillon. Deux comportements radicalement différents peuvent alors être observés suivant que le corps est un corps pur ou un mélange.
-
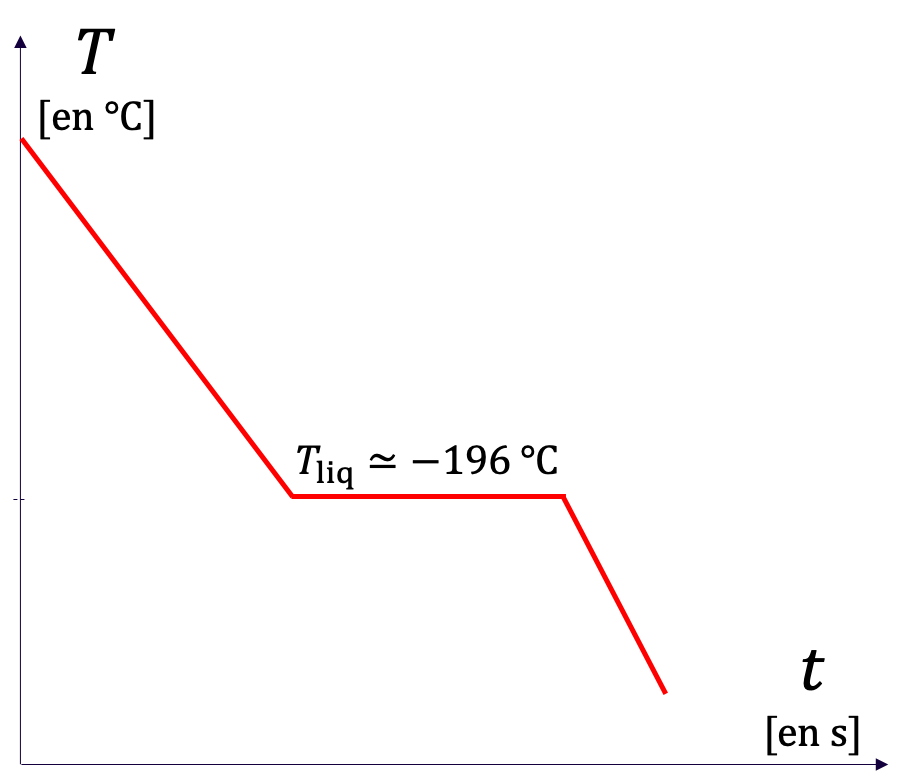
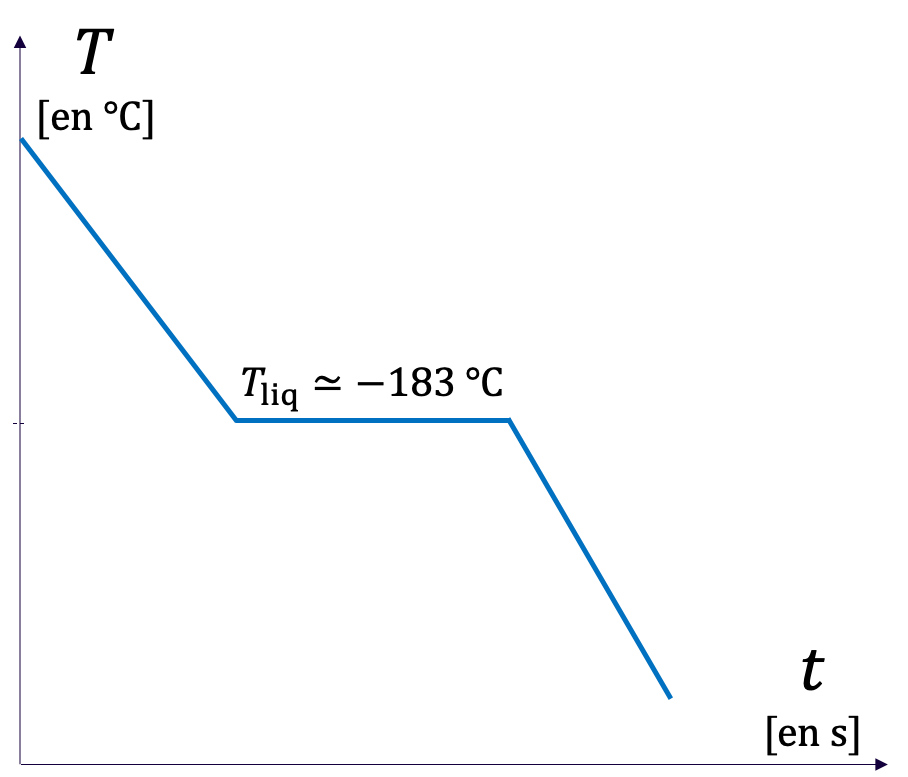
La courbe obtenue en faisant évoluer la température d'un échantillon s'appelle une courbe de température.
- La courbe de température d'un corps pur présente des palliers de changement d'état, c'est-à-dire des plateaux horizontaux (à température constante) qui correspondent à une coexistence de deux phases dans deux états de la matière différents.
- La courbe de température d'un mélange ne présente pas de pallier de changement d'état.
 |
 |
 |
| (a) Liquéfaction du diazote | (b) Liquéfaction du dioxygène | (c) Liquéfaction de l'air |
1.2. Masse volumique
Pour identifier un corps, il est possible de s'intéresser à ses propriétés intrinsèques (qui lui sont propres) comme la masse. On peut par exemple penser que le plomb ou l'or sont "plus lourds" que l'eau ou l'air. Toutefois, on peut se retrouver dans la situation présentée ci-après.
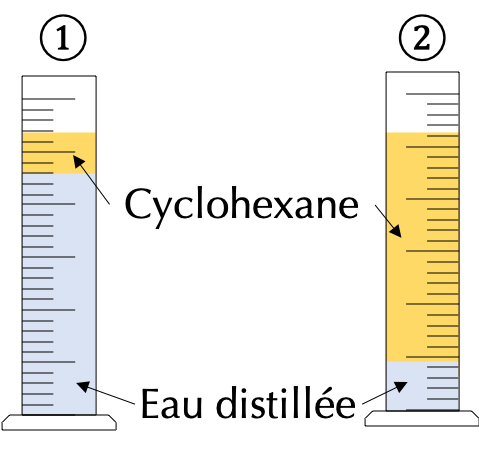
- L'eau est en excès par rapport au cyclohexane, la masse d'eau \(m_{\textrm{eau)}}\) est donc supérieure à la masse de cyclohexane \(m_{\textrm{cyclo)}}\). L'eau se retrouve en position inférieure dans l'éprouvette graduée.
- Le cyclohexane est en excès par rapport à l'eau. Cette fois les masses des deux constituants vérifient la relation suivante : \(m_{\textrm{eau)}} \leq m_{\textrm{cyclo)}}\). Pourtant, l'eau reste en position inférieure dans l'éprouvette graduée.
En réitérant le raisonnement précédent mais en raisonnant sur les volumes des deux constituants et non plus les masses, on tombe sur la même conclusion. Il est donc nécessaire de prendre en compte à la fois la masse \(m\) et le volume \(V\) du corps considéré. On parle ainsi de "densité" : le cyclohexane flotte sur l'eau car il est moins dense que cette dernière. Il ne reste donc plus qu'à définir une grandeur physique qui permette de caractériser la densité \(d\) d'un corps.
La masse volumique \(\mu\) (en \(\mathrm{kg \cdot m^{-3}}\) ou en \(\mathrm{g \cdot L^{-1}}\)) d'un corps est définie par la relation : $$\large \boxed{\mu = \frac{m}{V} \Leftrightarrow m=\mu \times V \Leftrightarrow V=\frac{m}{\mu}}$$ avec :
- \(m\) la masse du corps considéré en \(\mathrm{kg}\).
- \(V\) le volume du corps considéré en \(\mathrm{m^3}\).
|
|
Cette nouvelle grandeur permet d'expliquer pourquoi le cyclohexane flotte sur l'eau quelle que soit sa masse ou son volume : la masse volumique \(\mu_{\textrm{cyclo}}\) du cyclohexane est plus faible que celle de l'eau, notée \(\mu_{\textrm{eau}} \geq \mu_{\textrm{cyclo}}\).
Le système métrique ayant défini le kilogramme comme étant la masse d'un litre d'eau, la masse volumique de l'eau a une valeur facile à retenir : \(\mu_{\textrm{eau}}=1,00\ \mathrm{kg \cdot L^{-1}}=1\ 000\ \mathrm{kg \cdot m^{-3}}\)
La densité \(d\) d'un corps est définie à partir de sa masse volumique et de celle d'un corps de référence.
- Pour les solides et les liquides, le corps de référence est l'eau. On définit donc la densité \(d\) du corps de la manière suivante : $$\boxed{d_{\textrm{sol}}=\frac{\mu_{\textrm{sol}}}{\mu_{\textrm{eau}}}\quad \textrm{ou} \quad d_{\textrm{liq}}=\frac{\mu_{\textrm{liq}}}{\mu_{\textrm{liq}}}}$$
- Pour les gaz, le corps de référence est l'air dans les mêmes conditions de pression et de température, soit : $$\boxed{d_{\textrm{gaz}}=\frac{\mu_{\textrm{gaz}}}{\mu_{\textrm{air}}}}$$

- La masse volumique de l'or est \(\mu_{\textrm{Au}}\simeq 19,6\ \mathrm{kg \cdot L^{-1}}\), sa densité est donc \(d_{\textrm{Au}} \simeq 19,6\).
- La masse volumique de l'argent est \(\mu_{\textrm{Ag}}\simeq 10,5\ \mathrm{kg \cdot L^{-1}}\), sa densité est donc \(d_{\textrm{Ag}} \simeq 10,5\).
2. Identification par les propriétés chimiques
Pour vérifier la nature d'une substance, il est possible de recourir à ses propriétés chimiques et de réaliser une réaction chimique. Quatre tests d'identification chimiques sont au programme de seconde.
| Test au sulfate de cuivre anhydre | Test de l'allumette enflammée |
|---|---|
| Le sulfate de cuivre anhydre, de formule chimique \(\mathrm{Cu SO_4}\) est une poudre blanche qui devient bleue au contact de l'eau. Sa structure microscopique change, on la note \(\mathrm{Cu SO_4, 5\cdot H_2O}\) et on parle alors de sulfate de cuivre (penta)hydraté. | Pour permettre une combustion, il est nécessaire d'avoir trois éléments : une source de chaleur (flamme), un comburant (dioxygène de l'air) et un combustible. En approchant une allumette enflammée de gaz dihydrogène, une légère détonation se produit du fait de la réunion des trois éléments cités ci-avant (le dihydrogène étant un combustible). |
| Test à l'eau de chaux | Test de la buchette incandescente |
| L'eau de chaux est un mélange préparé à base d'eau et d'hydroxyde de calcium \(\mathrm{Ca(OH)_2}\). Son aspect est semblable à de l'eau ordinaire, mais en présence de dioxyde de carbone, l'eau de chaux se trouble et devient blanche du fait de la formation de carbonate de calcium : la même matière que dans les coquillages. | Une buchette incandescente ne peut se consumer qu'en présence d'un comburant comme le dioxygène de l'air. Une atmosphère riche en dioxygène ravive donc l'incandescence de la buchette. |
- L'eau est identifiée à l'aide du test au sulfate de cuivre anhydre.
- Le dihydrogène est identifié à l'aide du test de l'allumette enflammée.
- Le dioxyde de carbone est identifié à l'aide du test de l'eau de chaux.
- Le dioxygène est identifié à l'aide du test de la buchette incandescente.
3. Décomposer un mélange par CCM
Un mélange peut être décomposé selon les différents corps purs qui le constituent à l'aide d'une chromatographie sur couche mince (C.C.M.)
3.1. Effectuer une CCM
Pour effectuer une C.C.M., il est nécessaire de suivre le protocole suivant.
- On dispose l'échantillon à analyser (A) sur une plaque de silice au niveau d'une ligne de dépôt, tracée préalablement au crayon.
- On rajoute des dépôts de différents corps purs (B) et (C) que l'on cherche à identifier dans le mélange.
- On place la plaque de silice dans une cuve à élution avec un peu d'éluant au fond de la cuve.
- On ferme la cuve et on patiente environ \(20\ \mathrm{min}\).
- On récupère la plaque de silice pour la faire sécher.
Le schéma de l'expérience est représenté ci-dessous.
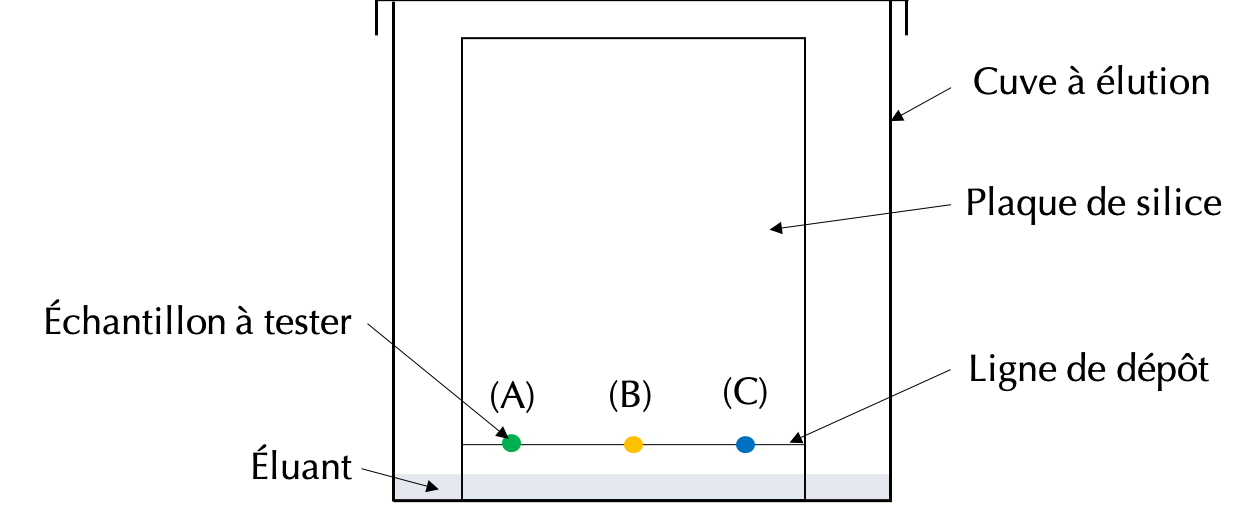
Une fois la plaque de silice plongée dans l'éluant, ce dernier remonte dans la plaque à la manière du café dans un morceaux de sucre : par capillarité. L'éluant emporte avec lui les différentes espèces chimiques déposées initialement sur la ligne de dépôt, qui migrent à différentes vitesses suivant leur affinité avec la plaque de silice.
L'éluant est un liquide donc la composition est choisie à chaque CCM, de manière à séparer au mieux les différents constituants de l'échantillon. Ça peut être de l'eau salée, un mélange eau-éthanol ou un éluant organique à base de cyclohexane par exemple.
3.2. Analyser une CCM
Si les différents constituants de l'échantillon sont des espèces chimiques non colorées, il est impossible de vérifier le résultat de la CCM à l'oeil nu. Il est nécessaire de procéder à une révélation.
La révélation est un procédé physique ou chimique consistant à identifier la position des tâches présentes sur une plaque de silice une fois la CCM terminée.
- Les deux méthodes principales de révélation d'une plaque de silice sont les suivantes :
- La révélation aux UV est basée sur un procédé physique. Une espèce chimique fluorescente est directement greffée à la plaque de silice. Lorsqu'une espèce chimique est présente sur la plaque, en la plaçant sous une lampe à UV, on observe une tâche à la position de chaque constituant.
- La révélation au permanganate de potassium est basée sur un procédé chimique. En trempant la plaque de silice dans une solution de permanganate de potassium, chaque constituant laisse une tâche à sa position comme dans la situation précédente.
Dans les deux cas de révélation, il est nécessaire d'entourer au crayon à papier les différentes tâches observées pour que l'on puisse analyser le résultat de la CCM sans devoir travailler en permanence sous un éclairage UV.
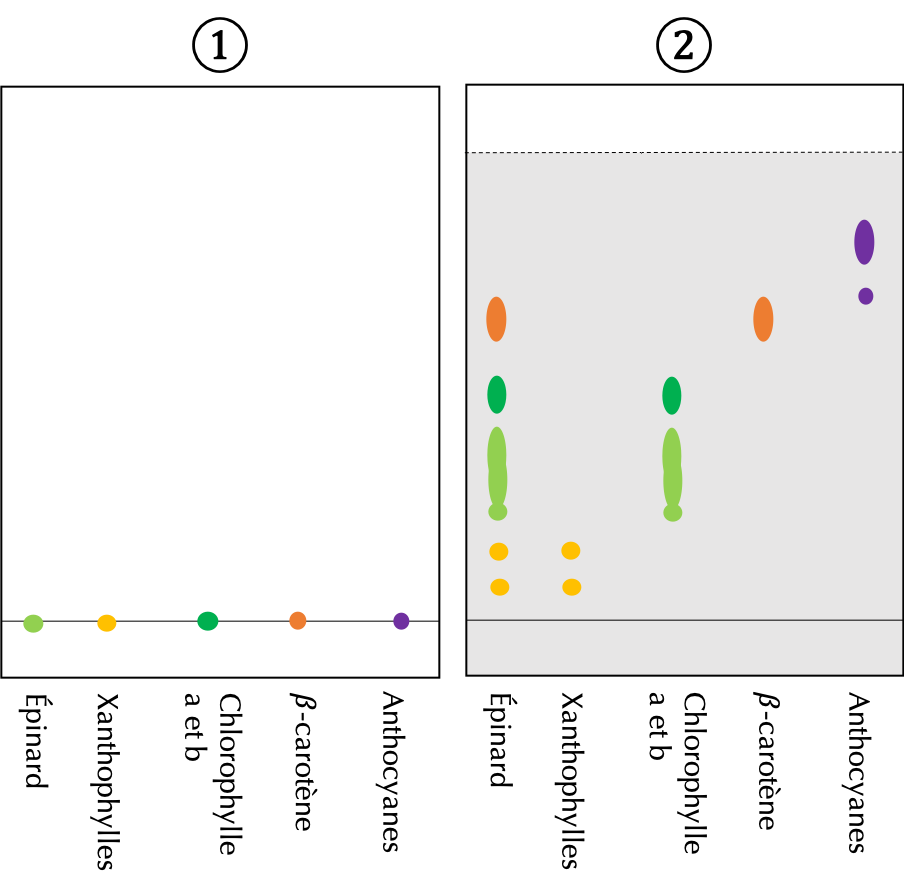
Une fois la position des différentes tâches identifiée, la lecture et l'analyse d'une plaque de CCM se fait en deux temps. Un exemple de CCM est illustré à la figure 4.
- Une lecture verticale :
La lecture verticale permet d'identifier si les espèces chimiques positionnées sur la ligne de dépôt sont des corps purs ou des mélanges.
- Un échantillon qui a migré en ne formant qu'une seule tâche est un corps pur.
- Un échantillon qui a migré en formant plusieurs tâches est un mélange.
Exemple :L'analyse verticale de la plaque de silice représentée ci-contre permet de conclure que :
- Le jus d'épinards est un mélange car le dépôt s'est séparé en plusieurs tâches.
- Les Xanthophylles, les chlorophylles a et b ainsi que les Anthocyanes sont des mélanges pour les mêmes raisons.
- Le \(\beta\)-carotène est un corps pur car le dépôt a migré sous la forme d'une seule tâche.
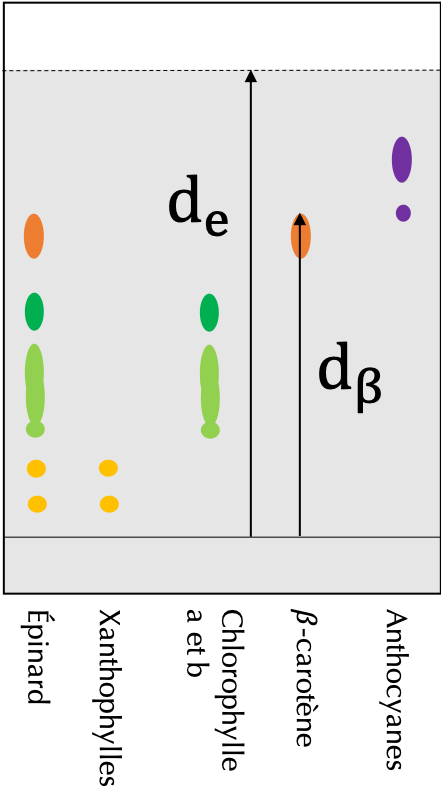
- Une lecture horizontale :
La lecture horizontale permet d'identifier la nature des espèces chimiques présentent dans l'échantillon déposé. En effet, une espèce chimique migre à la même vitesse, qu'elle soit dans un dépôt spécifique ou dans le dépôt de l'échantillon. Ainsi pour caractériser la "vitesse" de migration de l'espèce chimique, on utilise son rapport frontal par rapport au front de l'éluant.
Définition : rapport frontal \(r_f\)Le rapport frontal d'une espèce chimique par rapport au front de l'éluant est défini par la formule suivante : $$ \boxed{r_f = \frac{\textrm{Distance parcourue par l'espèce chimique}}{\textrm{Distance parcourue par l'éluant}}}$$
Exemple :Le calcul d'un rapport frontal est illustré à la figure 5, ci-contre. Le rapport frontal du \(\beta\)-carotène se calcule par exemple de la manière suivante : $$r_{f_{\beta}}=\frac{d_{\beta}}{d_e}\simeq 0,69$$
On remarque que le \(\beta\)-carotène a le même rapport frontal, qui se situe dans le dépôt de \(\beta\)-carotène ou dans le jus d'épinards. Il est donc possible de conclure quant à la composition du jus d'épinards :- Le jus d'épinards s'est décomposé en plusieurs tâches qui ont migré à la même distance que les xanthophylles, les chlorophylles a et b et le \(\beta\)-carotène. Le jus d'épinards contient donc ces quatre composants.
- Les anthocyanes ont cependant migré à une distance qui n'a pas d'équivalent dans le jus d'épinards. On peut donc en conclure que le jus d'épinards n'est pas constitué d'anthocyanes.