
La constitution de la matière à l'échelle microscopique a longtemps été un sujet de débats. Aristote proposait, dès la Grèce antique, une conception continue de la matière, alors qu'une conception discrète, proposée à la même époque par Démocrite d'Abdère, a longtemps été laissée de côté.

Il faudra attendre le \(\mathrm{XVIII}^\textrm{ème}\) siècle avec les travaux de
Chaque corps macroscopique est constitué d'un nombre fini d'entité "insécables" (ou "atomos" en grec) constituant la matière à l'échelle microscopique.
1. La constitution d'un atome
1.1. Édifice atomique
Un atome est un édifice microscopique électriquement neutre constitué d'une part d'un noyau de \(Z\) protons et de \(N=A-Z\) neutrons et d'autre part de \(Z\) électrons.
On nomme \(Z\) le numéro atomique, qui correspond au nombre de charges électriques constituant le noyau et \(A\) le nombre de masse correspondant au nombre de nucléons constituant le noyau.
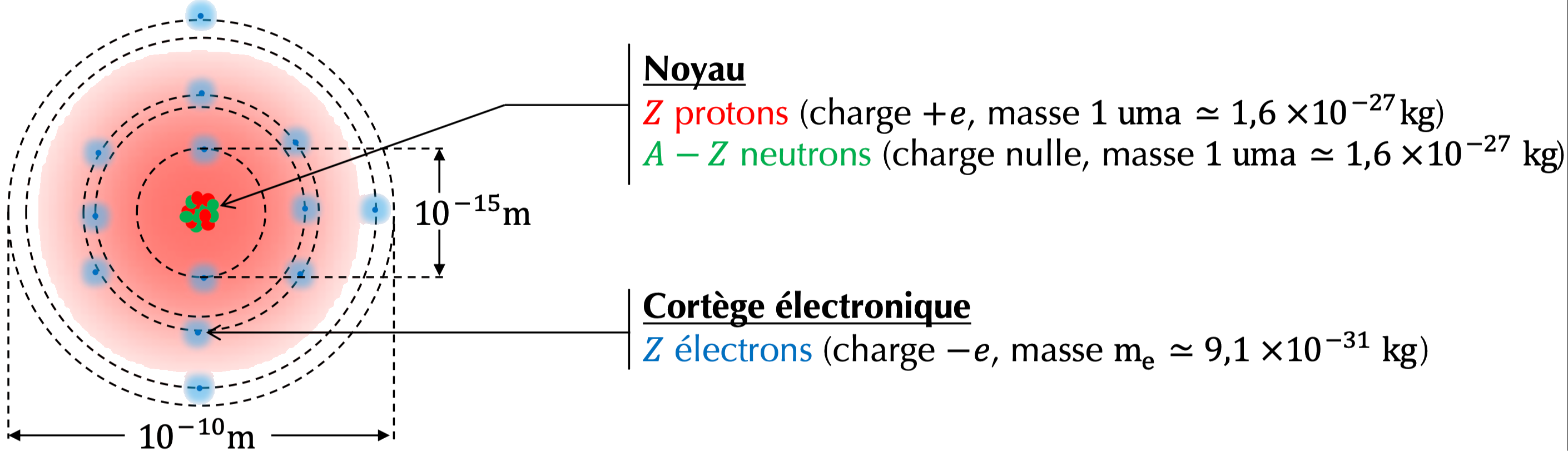
La charge électrique élémentaire est \(e \simeq 1,6 \times 10^{-19} \mathrm{C}\) et l'unité de masse atomique est \(1\ \mathrm{uma} \simeq 1,67 \times 10^{-27}\ \mathrm{kg}\).
- Pour un atome, il y a autant de protons que d'électrons pour conserver l'électroneutralité de la structure. Pour un ion, la différence entre le nombre de protons et le nombre d'électrons est la charge électrique totale de l'ion.
- Le proton est \(1835\) fois plus lourd que l'électron et le noyau est \(\sim 100 \ 000\) fois plus petit que le cortège électronique.
- \(10^{-10}\ \mathrm{m} = 1\ \overset{\circ}{A}\) (angstöm) et \(10^{-15} \ \mathrm{m} = 1 \ \mathrm{fm}\) (femtomètre).
Pour alléger la représentation graphique de l'atome, on propose la représentation symbolique suivante du noyau : $${\large \boxed{\mathrm{^{A}_{Z}X}}}$$
\(A\) représente le nombre de masses du noyau, \(Z\) le nombre de charges et \(X\) est le symbole de l'élément.
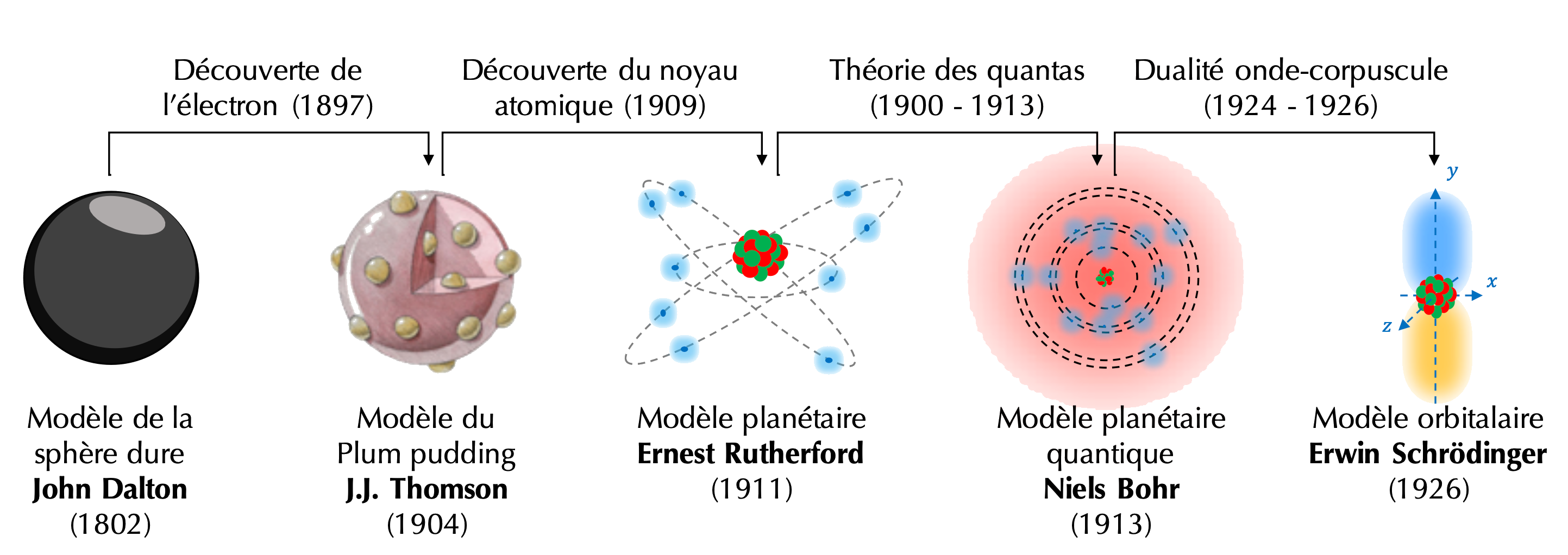
Différents modèles de l'atome se sont succédés dans le temps incluant à chaque fois les nouvelles découvertes de physiciens.
1.2. Les nombres quantiques
Chaque particule quantique confinée (comme un électron confiné dans le champ électrostatique du noyau) peut être détecté avec des niveaux discrets d'énergie dépendant de l'état quantique de la particule. On associe donc à chaque particule une fonction d'onde, notée \(\Psi(\vec{r},t)\), qui représente la probabilité de détection de la particule en \(\vec{r}\) à l'instant \(t\).
Dans le cas d'un électron dans un cortège électronique à trois dimensions, il est nécessaire de recourir à quatre nombres quantiques qui permettent de déterminer précisémment l'état de cet électron.
- Le nombre quantique principal \(n\) :
Ce nombre entier correspond à la couche électronique sur laquelle évolue l'électron, il évolue entre \(1\) et \(7\) ou \(8\) pour un atome "au repos".
Plus \(n\) est grand, plus l'électron "s'éloigne" du noyau.
En \(2006\), l'homme a synthéthisé le plus gros élément connu à ce jour : l'
Oganesson (\(Z=118\)), avec une couche quantique \(n=7\) totalement remplie. - Le nombre quantique secondaire \(\ell\) (ou azimutal) :
$$\boxed{0 \leq \ell \leq n-1}$$ \(\ell\) est un nombre entier, lié au moment cinétique de l'électron, qui donne sa représentation spatiale à la fonction d'onde \(\Psi (\vec{r},t)\). Ce nombre quantique correspond à la sous-couche électronique dans laquelle évolue l'électron.
Il y a \(n\) sous-couches dans une couche électronique.
\(\ell=0\)
Sous-couche \(s\) (sharp)
\(\ell=1\)
Sous-couche \(p\) (principal)
\(\ell=2\)
Sous-couche \(d\) (diffuse)
\(\ell=3\)
Sous-couche \(f\) (fundamental)
\(\ell=4\) Sous-couche \(g\) (ordre alphabétique) 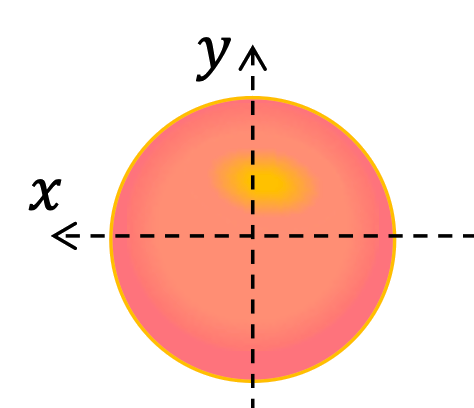
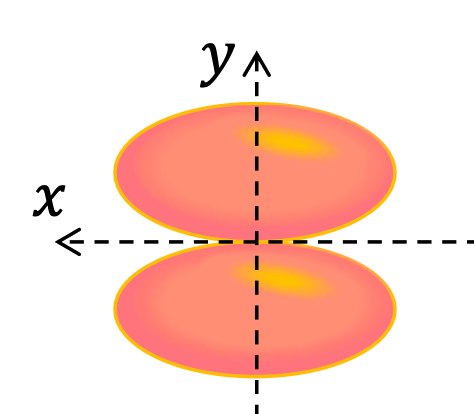
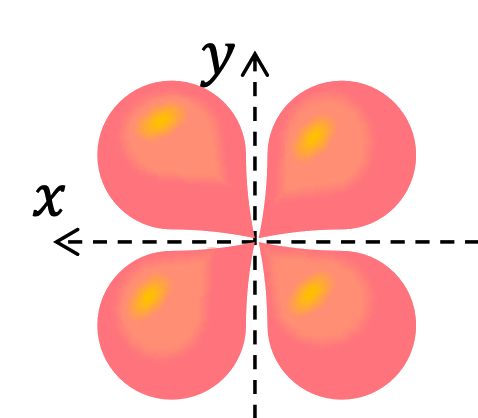

Les illustrations ci-dessus représentent graphiquement le module carré de la fonction d'onde \(|\Psi(\vec{r},t)|^2\) de certaines sous-couches électroniques : l'électron ayant une probabilité de \(95\%\) d'être détecté dans les "lobes" colorés autour du noyau.
- Le nombre quantique tertitaire \(m_\ell\) (ou magnétique) :
$$\boxed{-\ell \leq m_\ell \leq +\ell}$$ Le nombre quantique magnétique quantifie la valeur du moment magnétique de l'électron. La particule chargée étant en rotation autour du noyau atomique, elle agit comme un petit aimant dont l'orientation peut être mesurée et ne prenant que certaines valeurs discrètes.
Ce nombre quantique correspond à une
orbitale atomique et donne uneorientation spatiale aux divers lobes de la fonction de transfert.Il y a \(2\ell+1\) orbitales atomiques dans une sous-couche électronique.
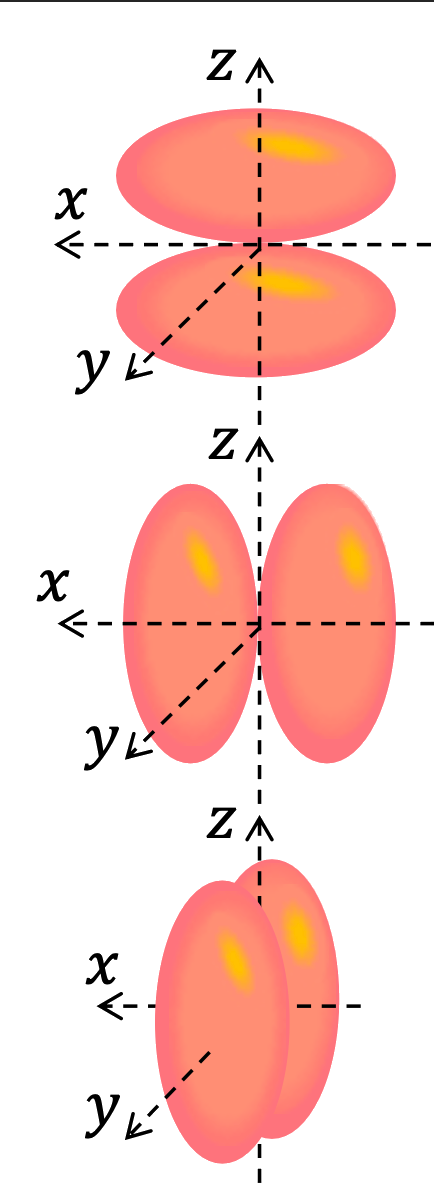
Pour une sous-couche \(s\) (\(\ell=0\)), le nombre quantique magnétique \(m_\ell\) ne peut prendre qu'une seule valeur : \(m_\ell=0\). La géométrie de la sous-couche est sphérique, il n'y a pas d'orientation privilégiée. Pour une sous-couche \(p\) (\(\ell=1\)), il y a trois valeurs possibles pour \(m_\ell\) : \(-1\), \(0\) ou \(1\) qui correspondent aux trois orientations spatiales possibles pour les lobes de la fonction d'onde : suivant la direction \(\vec{u_x}\), \(\vec{u_y}\) ou \(\vec{u_z}\) comme représenté ci-contre.
- Le nombre quantique de spin \(m_s\) :
Pour l'électron, le nombre quantique de spin peut prendre \(2\) valeurs : \(m_s = \pm \frac{1}{2}\).
Le spin est une propriété quantique, intrinsèque à la matière (comme la masse ou la charge électrique).
La fonction d'onde \(\Psi (\vec{r}, t)\) est parfaitement décrite avec la connaissance des quatre nombres quantiques \((n, \ell, m_\ell, m_s)\). Ces quatre nombres définissent ainsi l'
état de l'électron au sein du cortège électronique.
La représentation spatiale des orbitales atomiques dans le cas de l'atome d'hydrogène est faite dans la figure ci-après. Les nombres quantiques (\(n, \ell,m_\ell\)) sont indiqués en bas de chaque représentation.
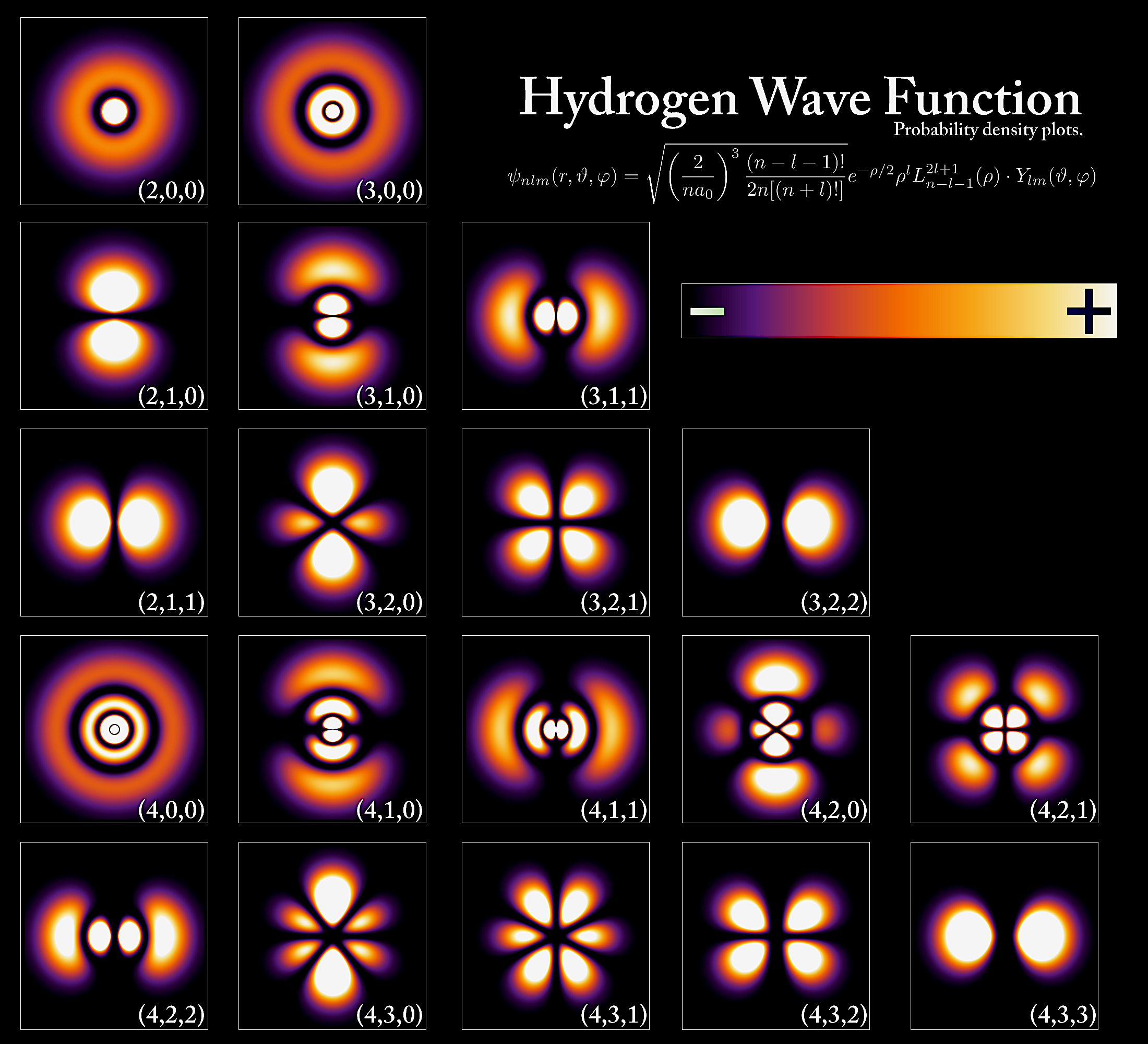
Le fait de connaître l'expression de la fonction d'onde et sa représentation graphique à partir
de la donnée des quatre nombres quantiques ne suffit pas à déterminer la composition exacte d'un
cortège électronique. Il est nécessaire pour cela d'établir les
Deux électrons ne peuvent pas être dans le même état quantique (\(n, \ell, m_\ell, m_s\)).
- C'est un principe
inviolable . Il s'agit de l'un des piliers de la mécanique quantique. - La donnée de (\(n, \ell, m_\ell\)) permet de définir une
orbitale atomique que l'on représente par une case, chaque flèche représentant un électron. Comme \(m_s\) ne peut prendre que deux valeurs (\(m_s = \pm \frac{1}{2}\)), si un électron de l'orbitale vérifie \(m_s = + \frac{1}{2}\), l'autre vérifiera nécessairement \(m_s = - \frac{1}{2}\). Les flèches sont ainsi orientées dans le "sens" où pointe le spin ( spin up ou spin down). -
On peut remplir jusqu'à \(2\) électrons par orbitale atomique et il y a \(2\ell + 1\)
orbitales atomiques par sous-couche électronique.
- Il y a au maximum \(2\) électrons par orbitale atomique.
- Il y a au maximum \(2\times (2\ell +1)\) électrons par sous-couche électronique \(\ell\).
- Il y a au maximum \(\displaystyle \sum_{\ell = 0}^{n-1}2 \times (2\ell+1) =2n(n-1)+2n=2n^2\) électrons par couche-électronique.
Une sous-couche \(s\) pourra ainsi contenir 2 électrons au maximum, 6 pour une sous-couche \(p\), 10 pour une sous-couche \(d\), 18 pour une sous-couche \(f\), etc.
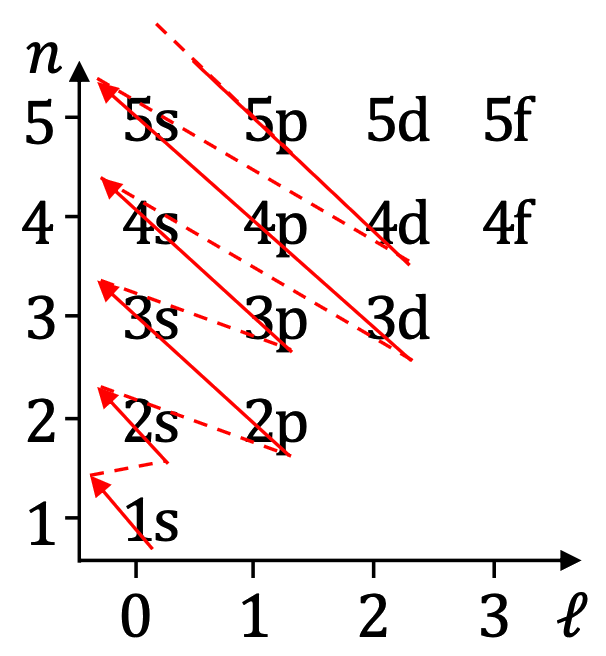
Les électrons sont rangés par niveau
- Par \(n+\ell\) croissant.
- Pour un \(n+\ell\) donné, par \(n\) croissant.
| L'élément potassium \(_{19}^{40}\mathrm{K}\) a \(19\) électrons. On peut représenter les différentes sous-couches électroniques dans un tableau identique à celui représenté ci-contre. Il est nécessaire, pour établir la configuration électronique du potassium, de suivre la règle de Klechkowski, autrement dit de suivre le tracé rouge ci-contre. Les niveaux d'énergie croissants sont ainsi : $$\mathrm{1s \rightarrow 2s \rightarrow 2p \rightarrow 3s \rightarrow 3p \rightarrow 4s \rightarrow 3d \rightarrow 4p \rightarrow 5s \rightarrow 4d \rightarrow 5p \rightarrow \ldots}$$ La configuration électronique du potassium sera ainsi notée : $$\mathrm{\left[_{19}^{40}\mathrm{K}\right] = (1s)^2(2s)^2(2p)^6(3s)^2(3p)^6(4s)^1 = \left[_{18}^{40}\mathrm{Ar}\right](4s)^2}$$ |
|
-
Il existe des
exceptions à la règle de Klechkowski. Deux sont à connaître :- Le chrome a pour configuration électronique \(\mathrm{\left[ Cr \right]= (1s)^2(2s)^2(2p)^6(3s)^2(3p)^6(4s)^{1} (3d)^{5}}\). La sous-couche \(3d\) a moitié pleine confère au chrome une configuration électronique plus stable en transférant un électron depuis sa sous-couche \(4s\) vers sa couche \(3d\).
- Le cuivre a pour configuration électronique \(\mathrm{\left[ Cu \right]= (1s)^2(2s)^2(2p)^6(3s)^2(3p)^6(4s)^{1} (3d)^{10}}\). La sous-couche \(3d\) totalement pleine confère au cuivre une configuration électronique plus stable en transférant un électron depuis sa sous-couche \(4s\) vers sa couche \(3d\).
- Les configurations électroniques décrites à l'aide de la règle de Klechkowski sont
valables pour des éléments isolés en
phase gaz à l'état fondamental, c'est-à-dire à l'état de plus basse énergie. - Dans le cas des métaux de transition en solution aqueuse (forme ionique), les blocs
\(s\) et \(d\) s'inversent généralement.
L'indium a pour configuration électronique \(\mathrm{[In]=[Kr](5s)^2(4d)^{10}(5p)^{1}}\) dans l'état gazeux, mais l'ion indium en solution aqueuse a pour configuration électronique \(\mathrm{[In^{2+}]=[Kr](4d)^{10}(5s)^{1}}\).
Le
Dans le cas du phosphore (\(Z=15\)), la configuration électronique s'écrit \(\mathrm{[P] = [Ne] (3s)^2 (3p)^3}\). On peut détailler l'occupation des différentes orbitales atomiques.

Les configuration n°1 et configuration n°5 sont les plus stables car le spin est extrême : maximal pour la configuration n°1 et minimal pour la configuration n°5.
Chaque orbitale atomique est associée à une énergie bien définie. Les niveaux d'énergie dans l'atome sont donc quantifiés.
1.3. Électrons de valence
Pour les éléments des blocs \(s\) et \(p\) de la classification périodique, les
D'une manière générale, les électrons de valence appartiennent :
- à la dernière couche \(n\).
- à la dernière sous-couche \((n-1)d\) non remplie.
- à la dernière sous-couche \((n-2)f\) non remplie.
Pour les trois premières périodes de la classification, on peut représenter facilement les électrons de valence.
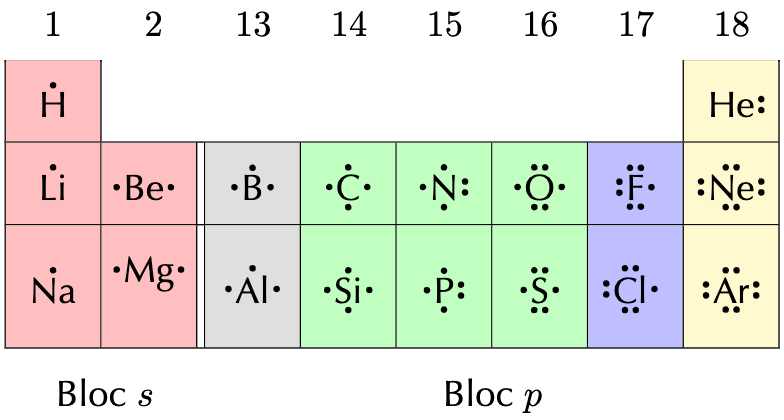
On peut retenir le tableau suivant pour identifier le nombre d'électrons de valence pour chaque élément :

- Dans la nature, seuls les
gaz nobles sont trouvés sous forme d'atomes isolés. Leur cortège électronique constitué de \(2\) ou \(8\) électrons de valence sature leur dernière couche électronique ce qui leur confère une certaine stabilité. - Tous les autres éléments
s'associent sous forme de molécule ouéchangent des électrons pour former des ions dans le but d'avoir uncortège électronique identique au gaz noble le plus proche . - Les structures qui ne vérifient pas la règle 2 sont généralement très réactives chimiquement voire instables.
En résumé : les élements en rouge ont tendance à former des cations pour se stabiliser, les élements en bleu ont tendance à former des anions, les éléments en vert ont tendance à s'assembler à d'autres éléments pour former des molécules et les éléments en jaune sont des gaz nobles, stables sous forme d'atomes.
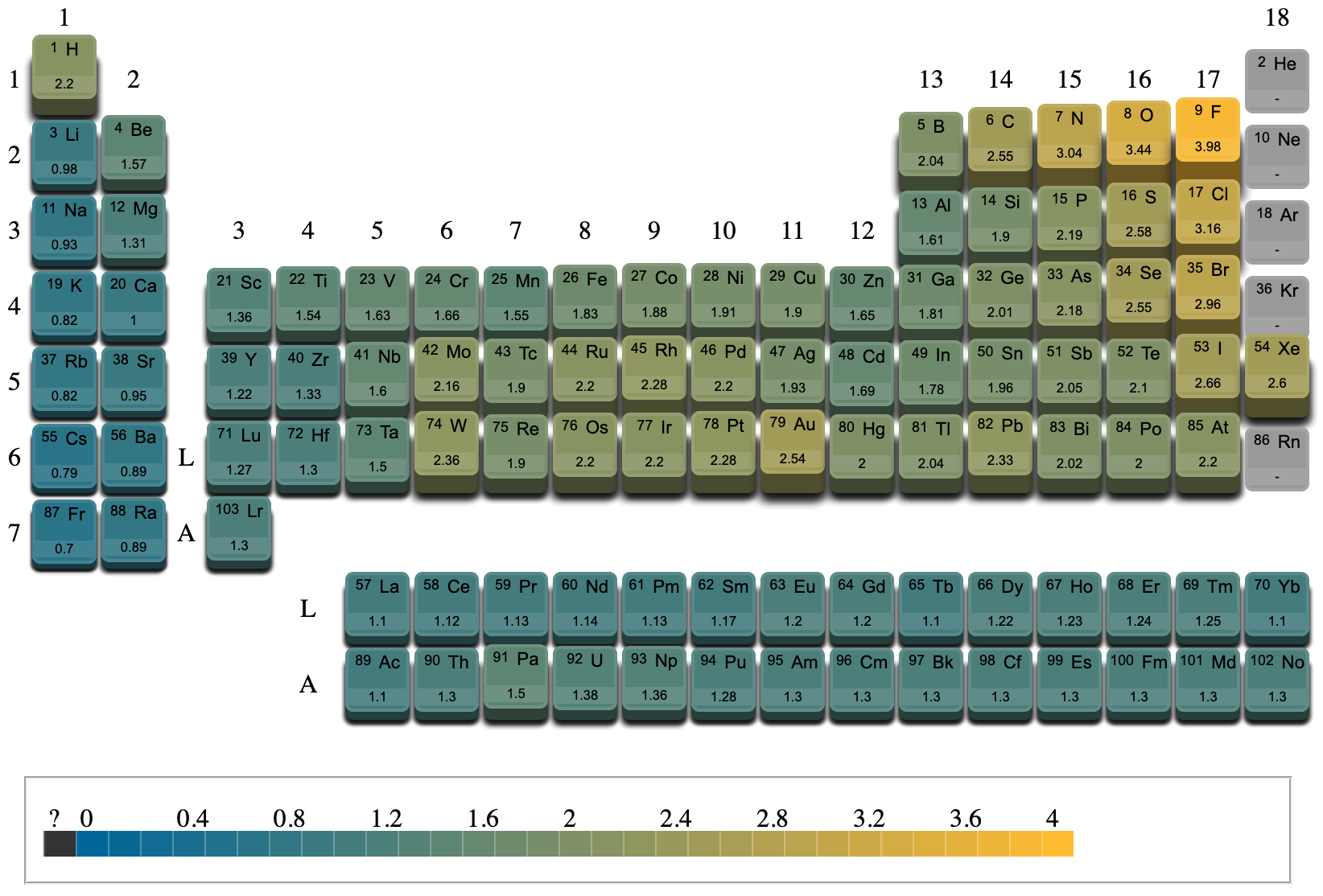
1.4. Électronégativité
L'électronégativité d'un atome permet de mesurer le pouvoir d'attraction des électrons de valence par un noyau atomique.
Il existe deux échelles, l'échelle de Pauling et l'échelle de Mulliken qui se basent sur deux définitions différentes de l'électronégativité mais dont la tendance globale est la même : l'électronégativité est croissante en se rapprochant du fluor.
L'électronégativité d'un élément \(\mathrm{X}\) est notée \(\chi (\mathrm{X})\),
Plus l'électronégativité \(\chi(\mathrm{X})\) d'un élément \(\mathrm{X}\)
augmente, plus cet élément a un cortège électronique
2. Structure des entités chimiques
2.1. La liaison covalente
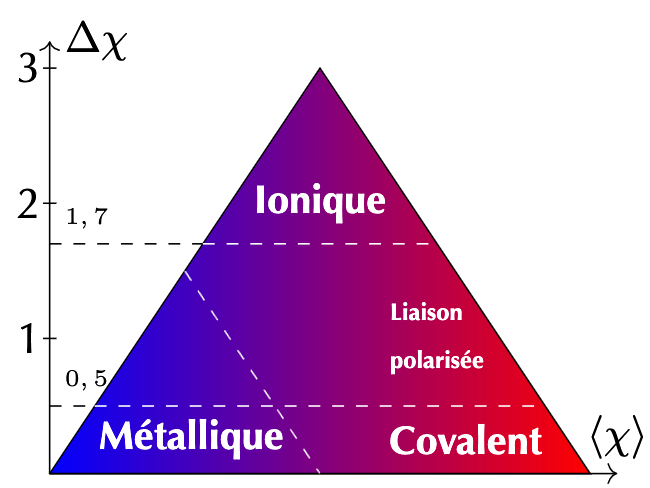
La liaison covalente résulte de la mise en commun d'au moins deux électrons de valences par deux entités différentes.
Les deux entités qui forment une liaison covalente doivent être d'électronégativité très élevée, dans ce cas \(\Delta~\chi~\simeq~0\) mais \(\overline{\chi}~\rightarrow~4\). Les éléments concernés sont principalement ceux situés en haut à gauche de la classification périodique.
le carbone, l'azote, le fluor, le chore, etc
La liaison covalente entre deux atomes peut être :
- Simple si une seule paire d'électrons de valence est mise en commun.
Liaison \(\mathrm{H-H}\) dans le dihydrogène.
- Double si deux paires d'électrons de valence sont mises en commun.
Liaison \(\mathrm{O = O}\) dans le dioxygène.
- Triple si trois paires d'électrons de valence sont mises en commun.
Liaison \(\mathrm{N \equiv N}\) dans le diazote.
Quelques (gros) éléments assez marginaux sont capables de former des liaisons quadruples impliquant quatre paires d'électrons de valence.
D'autres types de liaisons sont possibles entre deux entités.
- Dans le cas de la liaison ionique, il n'y a pas de mise en commun d'électrons puisque la différence d'électronégativité entre les deux entités est trop élevée.
- Dans le cas de la liaison métallique, il y a une mise en commun des électrons dans l'ensemble du cristal. Il n'y a pas de liaison localisée. (cf. cristallographie).
- Plus un atome est électronégatif, plus son cortège électronique est contracté.
- Les énergies de liaisons dépendent de l'ordre de liaison :
Liaison Simple Double Triple Énergie de liaison (en \(\mathrm{kJ \cdot mol^{-1}}\)) ~400 ~600 ~800 Énergie de liaison (en \(\mathrm{eV}\)) ~2 ~3 ~4 - La longueur de liaison est de l'ordre de \(\ell=100 \ \mathrm{pm} = 1 \ \mathrm{\overset{\circ}{A}}\), soit la taille approximative d'un cortège électronique : dans une liaison covalente, les deux entités sont "collées".
2.2. Représentation de Lewis
Dans la représentation de Lewis :
- Les électrons de valence sont regroupés par paires (ou doublets) et
représentés avec un trait.
- Un doublet qui forme une liaison covalente avec une autre entité est appelé doublet liant.
- Un doublet qui ne forme pas de liaison covalente est appelé doublet non liant.
- Les électrons restants sont appelés électrons célibataires ou électrons non appariés.
Si une entité présente un électron non apparié, l'espèce chimique est qualifiée de "radicalaire " et est très réactive.
La représentation d'une molécule sous forme de structure de Lewis vérifie un protocole simple. On se base ici sur l'exemple de la molécule de dioxyde de soufre (\(\mathrm{SO_2}\)).
- Compter la somme des électrons de valence de chaque atome dans la molécule.
Ici, le soufre (\(\mathrm{S}\)) a 6 électrons de valence et chaque oxygène (\(\mathrm{O}\)) a 6 E.V. Il y a donc en tout 18 E.V.
- En déduire le nombre de paires de valence.
On a donc ici 18/2=9 paires de valence. Si le nombre d'E.V. n'était pas pair, on aurait eu un électron libre supplémentaire pour former un électron non apparié.
- Disposer l'atome central (généralement le plus rare dans la molécule) au centre de la
molécule et on le relie à chaque élément par une liaison simple.
L'atome central est le soufre (\(\mathrm{S}\)), on dispose donc la molécule de cette manière \(\mathrm{O-S-O}\)
- Compléter la molécule avec des doublets liants (liaisons multiples) ou non
liants afin que chaque atome s'entoure d'autant d'électrons que le gaz noble qui lui
est le plus proche dans la classification périodique.
Les éléments \(\mathrm{P}\), \(\mathrm{S}\), \(\mathrm{C\ell}\) sont hypervalents et peuvent former plus de quatre liaisons covalentes.
On a le droit à 9 paires de valence pour seulement 2 utilisées, on doit donc placer les 7 paires de valence restantes comme suit
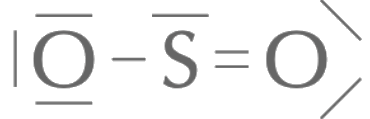 ou
ou 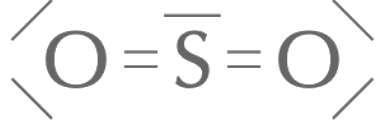 . Chaque atome
vérifie bien la règle de l'octet.
. Chaque atome
vérifie bien la règle de l'octet. - Calculer les charges formelles de chaque atome. Le mésomère le plus stable sera celui
où il y a le moins de charges formelles et où les atomes les plus électronégatifs portent
les charges \(\ominus\).
L'oxygène et le soufre libres ont 6 E.V. Or, l'oxygène de gauche s'est entouré de 7 E.V. (charge -1) et le soufre seulement de 5 (charge +1). On obtient donc la représentation de Lewis du dioxyde de soufre :
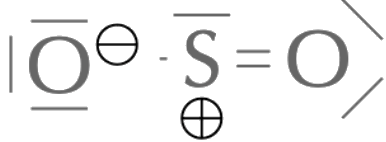 ou
ou 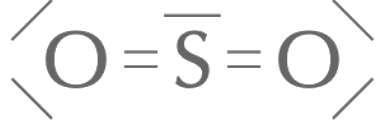 .
.
On retiendra que :
- La représentation de Lewis permet de représenter schématiquement le cortège électronique d'atome, de molécules ou d'ions sans présumer de leur struture 3D.
- Géométriquement, les doublets (liants et non liants) se repoussent de manière à minimiser l'énergie potentielle de la struture.
2.3. Moment dipolaire d'une liaison
Lorsque deux entités d'électronégativités différentes forment une liaison covalente, les électrons sont plus attirés par l'entité la plus électronégative : il est résulte un moment dipolaire \(\vec{p}\) de la liaison.
|
Le moment dipolaire \(\vec{p}\) est défini par : $$\vec{p} = \delta e \vec{NP}$$ avec :
|
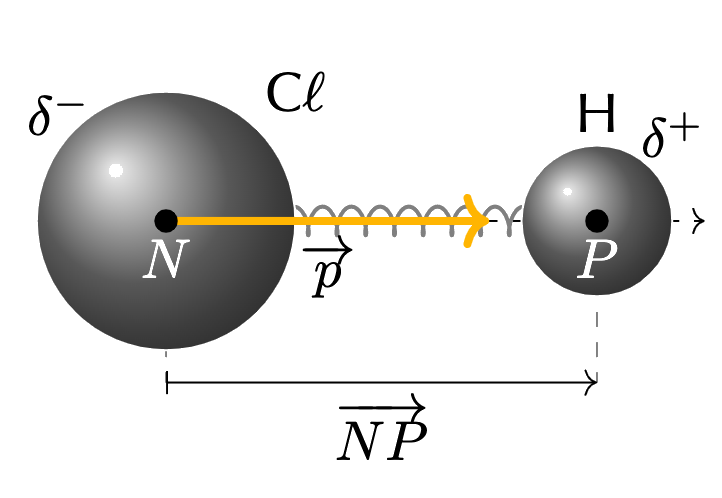
|
Le moment dipolaire est exprimé en debye (\(1\ \mathrm{D} \simeq 3,3 \times 10^{-30} \ \mathrm{C \cdot m^{-1}}\)).
2.4. Géométrie et polarité des entités chimiques
Dans une molécule ou un ion polyatomique qui comporte plus de deux entités, le moment dipolaire total \(\vec{p}\) de la molécule est la somme vectorielle des moments dipolaires de chaque liaison. $$\boxed{\vec{p} = \underset{n \textrm{ liaisons}}{\underbrace{\vec{p_1}+\ldots +\vec{p_n}}}}$$
La molécule sera ainsi qualifiée de :- polaire si \(\vec{p} \neq \vec{0}\).
- apolaire si \(\vec{p} = \vec{0}\).
3. Lien entre la structure et les propriétés d'une entité
3.1. Interactions entre entités
3.1.1. Interaction de Van der Waals
À l'échelle microscopique, chaque molécule a un cortège électronique qui se déforme sous l'action d'un champ électrique extérieur. Si la molécule présentait déjà un moment dipolaire non nul, on parle de dipôle permanent. Si la molécule avait un moment dipolaire nul mais que la déformation du nuage électronique lui en fait acquérir un, on parle de dipôle induit.
Interaction de London : Cette interaction a lieu entre deux dipôles induits. L'énergie potentielle d'interaction associée à ce type d'interaction est de la forme : $$\mathcal{E}_{\textrm{London}} = -\frac{K_{\textrm{London}}}{ r^6} \Rightarrow F_{\textrm{London}} = -\frac{\mathrm{d} \mathcal{E}_{\textrm{London}} }{\mathrm{d} r}=-\frac{K_{\textrm{London}}}{ r^7}$$
deux molécules de diiode.
|
interaction de Debye : Cette interaction a lieu entre un dipôle induit et un
dipole permanent.
$$\mathcal{E}_{\textrm{Debye}} = -\frac{K_{\textrm{Debye}}}{ r^6} \Rightarrow F_{\textrm{Debye}} = -\frac{\mathrm{d} \mathcal{E}_{\textrm{Debye}} }{\mathrm{d}
r}=-\frac{K_{\textrm{Debye}}}{ r^7}$$
une molécule de diiode et une molécule d'eau. |
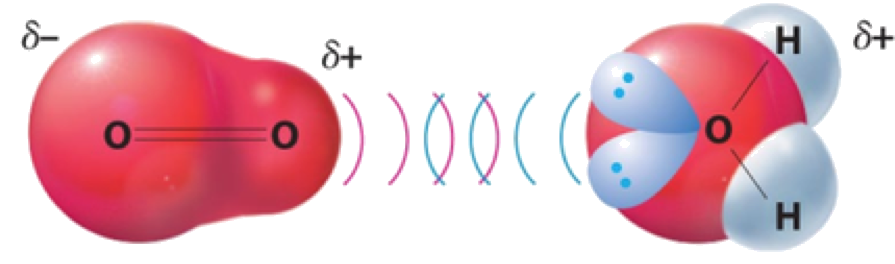 |
Interaction de Keesom : Cette interaction a lieu entre deux dipôles permanents. $$\mathcal{E}_{\textrm{Keesom}} = -\frac{K_{\textrm{Keesom}}}{ r^6} \Rightarrow F_{\textrm{Keesom}} = -\frac{\mathrm{d} \mathcal{E}_{\textrm{Keesom}} }{\mathrm{d} r}=-\frac{K_{\textrm{Keesom}}}{ r^7}$$
deux molécules d'eau.
Les interactions de Van der Waals sont reponsables d'une énergie potentielle d'interaction de la forme : $$\mathcal{E}_{\textrm{VdW}}=\frac{1}{ r^6}\left(K_{\textrm{London}}+K_{\textrm{Debye}} +K_{\textrm{Keesom}}\right)$$
Plus les cortèges électroniques des éléments sont gros et plus ils sont polarisables. Ces éléments sont donc soumis à plus de forces de van der Waals.
Les forces de van der Waals sont des forces intermoléculaires attractives responsables de la cohésion de la matière à l'échelle macroscopique.
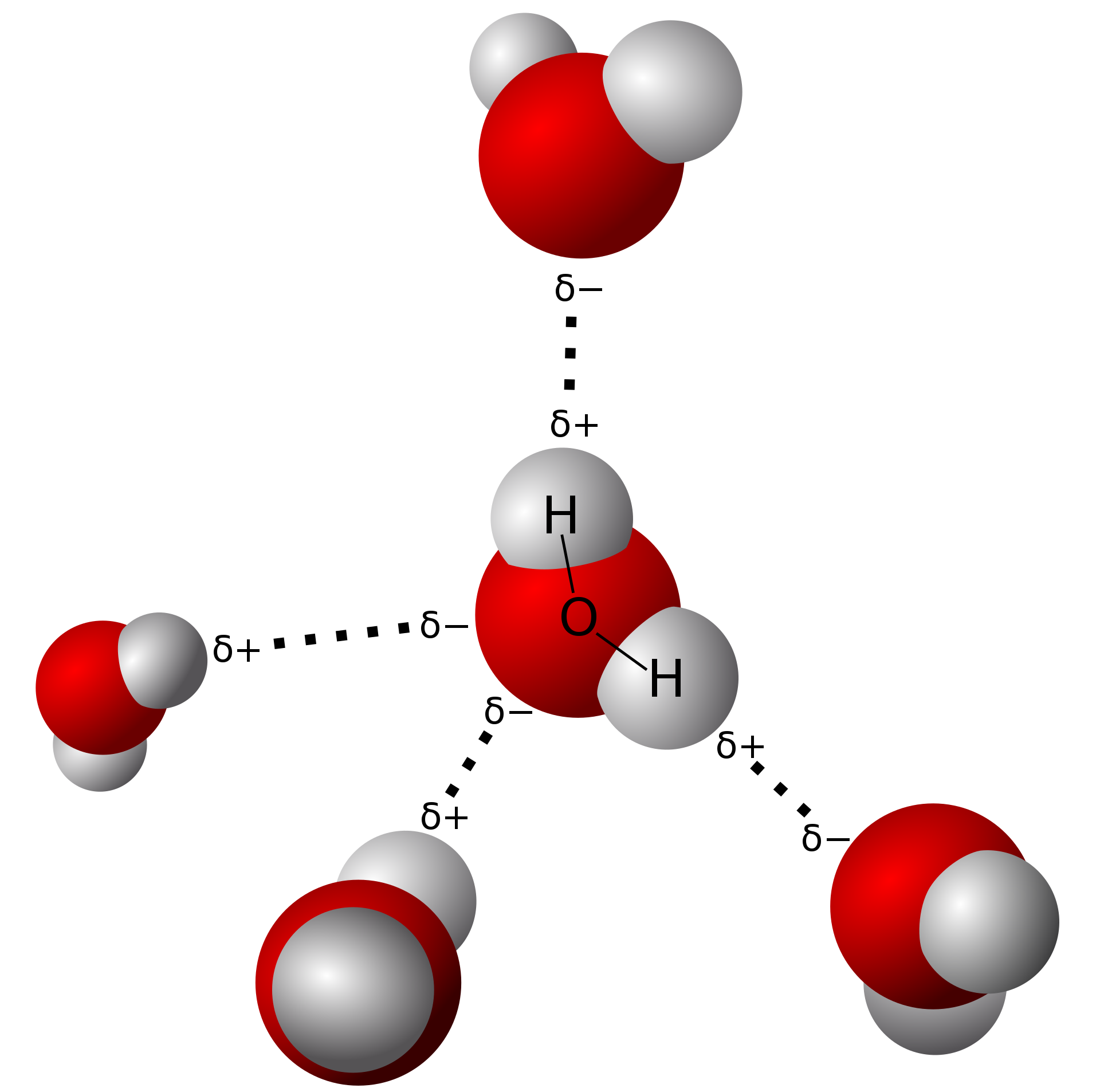
3.1.2. Liaison hydrogène - interaction par pont hydrogène
Un pont hydrogène (ou liaison hydrogène) ne peut être formée entre deux molécules qu'à deux conditions :- La présence d'un atome d'hydrogène à côté d'un atome très électronégatif sur l'une des molécules.
- La présence d'un doublet non liant sur un atome électronégatif sur l'autre molécule.
L'énergie nécessaire pour briser une liaison hydrogène est de l'ordre de \(\mathcal{E}~\sim~4~\textrm{ à }~40~\ \mathrm{kJ \cdot mol^{-1}}\).
|
Dans la glace, la présence d'atomes d'hydrogène et d'atomes d'oxygène présentant deux doublets non liants permet d'obtenir une liaison hydrogène entre chaque molécule. |
 |
3.2. Effet sur la température de changement d'état
L'énergie thermique microscopique d'une (petite) molécule est de l'ordre de \(k_B T\) avec \(k_B~\simeq~1,38~\times~10^{-23}~\ \mathrm{J \cdot K^{-1}}\) la constante de Boltzmann.
- Les liaisons atomiques et moléculaires sont responsables de l'agencement et de la cohésion de la matière.
- L'agitation thermique entre en compétition avec l'énergie desdites liaisons en agitant spatialement les constituants du milieu.
- Pour un liquide avec des interactions de Van der Waals, \(\mathcal{E} \sim 2 \ \mathrm{kJ \cdot mol^{-1}}\), soit \(T \sim \frac{2 \times 10^{3}}{1,38 \times 10^{-23} \times 6,022 \times 10^{23}} \sim 240 \ \mathrm{K}\).
- S'il y a en plus des liaisons hydrogène, \(T \sim \frac{4 \textrm{ à } 40 \times 10^{3}}{1,38 \times 10^{-23} \times 6,022 \times 10^{23}} \sim 480 \textrm{ à } 5000 \ \mathrm{K}\).
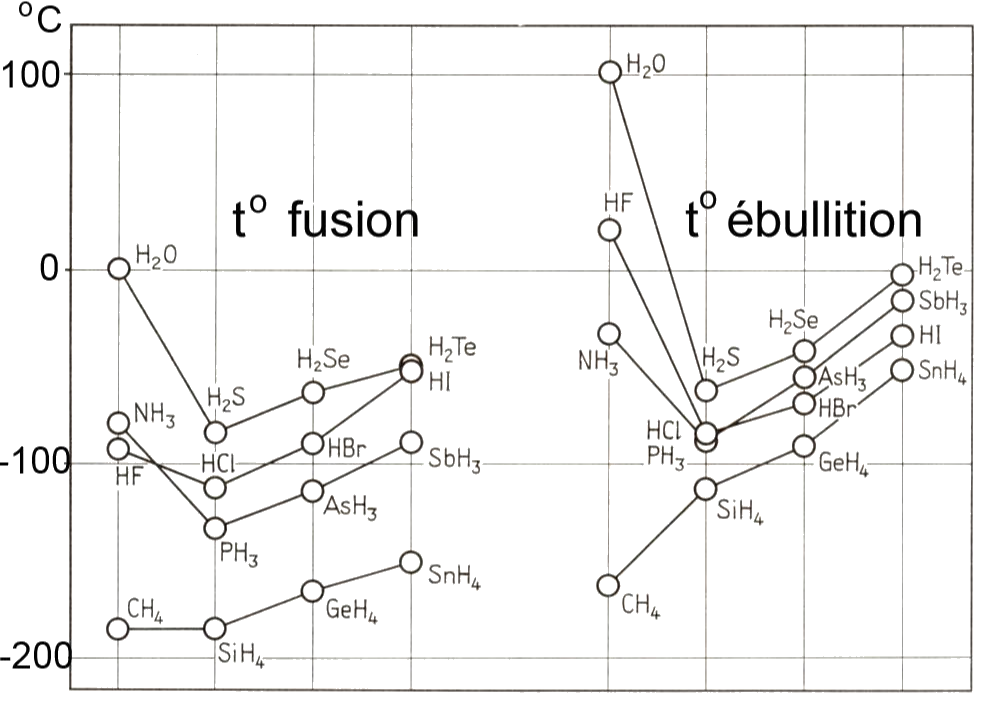

La présence de liaison hydrogène pour H2O, NH3, etc impose une température de fusion élevée.
Plus l’élément est gros et plus son cortège électronique est polarisable, il est soumis à plus d’interaction de London et sa température de fusion augmente (augmentation quasi-linéaire avec le volume (polarisabilité) des molécules).
3.3. Solubilité - miscibilité
3.3.1. Propriétés du solvant
- Un solvant est dit ionisant lorsque le moment dipolaire \(\vec{p}\) de ses entités
microscopiques est suffisant pour pouvoir séparer un sel en une paire d'ions.
L'eau a un moment dipolaire \(p\simeq 1,85 \ \mathrm{D}\), c'est un solvant ionisant.
- Un solvant est dit dissociant lorsque sa permittivité relative \(\varepsilon_r\) est élevée. La permittivité relative (sans
dimension) quantifie la qualité de l' écrantage des charges électriques
dissoutes par les molécules du solvant.
L'eau a une permittivité relative \(\varepsilon_r \simeq 80\). Le champ électrique ressenti par une charge électrique dans l'eau est donc \(80\) fois plus faible que dans le vide. L'eau a un fort pouvoir d'écrantage des charges : c'est un solvant dissociant.
- Un solvant est dit protique lorsqu'il est
capable de libérer des protons \(\mathrm{H^+}\) dans le milieu.
L'eau possède deux hydrogènes sur son atome d'oxygène (électronégatif). L'eau est donc susceptible de libérer un proton \(\mathrm{H^+}\) : c'est un solvant protique.
3.3.2. Les trois étapes de la dissolution
- Ionisation
$$ \mathrm{\underset{\textrm{Cristal}}{NaC\ell_{(s)}} \overset{\textrm{ionisation}}{\leftrightarrows} \underset{\textrm{Paire d'ions}}{(Na^+, C\ell^-)_{(aq)}}}$$ La polarisation de la liaison est accrue jusqu'à donner deux ions, liés entre eux par une interaction de type électrostatique (énergie d'interaction de coulomb).
- Dissociation
$$ \mathrm{ \underset{\textrm{Paire d'ions}}{(Na^+, C\ell^-)_{(aq)}} \overset{\textrm{dissociation}}{\leftrightarrows} \underset{\textrm{ions}}{Na^{+} + C\ell^{-}}}$$ Les deux ions sont séparés, il faut apporter de l'énergie au système (sous forme thermique) pour séparer les deux ions (déstabilisation du système).
- Solvatation (hydratation dans le cas de l'eau) :
$$ \mathrm{ \underset{\textrm{ions}}{Na^{+} + C\ell^{-}} \overset{\textrm{solvatation}}{\leftrightarrows} \underset{\textrm{ions aqueux}}{Na^{+}_{\textrm{(aq)}} + C\ell^{-}_{\textrm{(aq)}}}}$$ L'étapes de solvatation est une étape de création d'interactions attractives (d'origine électrostatique) entre le solvant et les ions. Ces interactions sont stabilisantes.
Les interactions soluté/soluté sont remplacées par des interactions soluté/solvant de même nature, ce qui est peu coûteux en énergie.
"Qui se ressemble s'assemble"
- Un soluté polaire dans un solvant polaire sera soluble. Un solvant polaire sera miscible dans un autre solvant polaire.
- Un soluté apolaire sera peu soluble dans un solvant polaire. Un solvant apolaire sera non miscible dans un solvant polaire.