
À l'échelle macroscopique, c'est-à-dire à une échelle observable à l'oeil nu, la matière est présente sous différents aspects. À l'échelle microscopique, c'est-à-dire à l'échelle des entités qui la composent, la matière est constituée d'un ensemble d'entités chimiques présentant des propriétés diverses. Certains corps (systèmes que l'on étudie) possèdent la caractéristique de n'être composés que d'un seul type d'entités. Ces corps, appelés corps purs, présentent des propriétés physiques particulières énoncées dans ce chapitre.
1. Espèce chimique
La matière à l'échelle microscopique est constituée de milliards de milliards d'entités chimiques ayant entre-elles des propriétés très variables. Toutefois, certaines matières présentent la caractéristique d'être principalement composées d'un seul type d'entités chimiques, leur conférent ainsi des propriétés physiques et chimiques plus simples à étudier que pour d'autres corps.Une espèce chimique regroupe l'ensemble des entités chimiques de même nature.
Un échantillon est un morceau de matière (ou corps) qui est étudié. Il est constitué d'une ou de plusieurs espèces chimiques.
Un échantillon est un corps pur s'il n'est constitué que d'une seule espèce chimique.
Tous les objets du quotidien peuvent être classés en deux catégories : ceux qui sont des corps purs et ceux qui ne le sont pas. Le tableau suivant propose une répartition de quelques échantillons :
| Corps purs | Pas un corps pur |
|---|---|
|
|
2. Les trois états du corps pur
Une phase est un volume de l'espace où l'on peut considérer continu l'ensemble des propriétés physiques et chimiques du milieu. Elle est délimitée par une frontière bien distincte dont l'épaisseur est négligeable devant la taille du système étudié.
Un état physique correspond à une organisation microscopique de la matière.
Le corps pur existe dans la nature sous trois états qui sont les états solide, liquide ou gazeux.
Finalement, plusieurs phases peuvent exister pour un corps pur dans un état.
On peut résumer graphiquement les trois états de la matière en représentant les entités chimiques dans un tableau (toutes les entités chimiques sont de même nature si l'on veut considérer une seule espèce chimique) :
| État solide | État liquide | État gazeux |
|---|---|---|
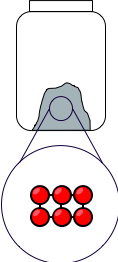
|
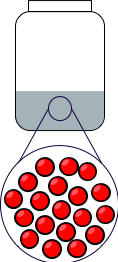
|
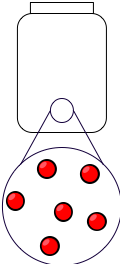
|
Figure 1 : Les trois états du corps pur.
- L'état solide se caractérise par une faible agitation thermique des entités chimiques, avec une énergie de liaison suffisamment forte par rapport à l'énergie thermique pour ordonner la matière à l'état microscopique.
- L'état liquide est caractérisé par une énergie thermique supérieure qui désorganise la matière : on parle d'état désordonné.
- L'état gazeux possède une énergie thermique beaucoup plus grande que l'énergie de liaison entre entités chimiques. À l'échelle microscopique, l'agitation des entités est telle qu'elles occupent tout l'espace qui leur est offert.
3. Les changements d'état du corps pur
3.1. Définitions
Une transition de phase correspond à une réorganisation de la matière à l'échelle microscopique. Il en résulte une variation de certaines propriétés physiques ou chimiques.
Un changement d'état est un type particulier de transition de phase pour lequel les deux phases étudiées sont deux états de la matière.
- La transition vitreuse pour un polymère correspond à la transition faisant passer le polymère d'une phase dite "vitreuse" à une phase "caoutchouteuse".
- À très basse température, certaines espèces chimiques liquides subissent une transition de phase pour devenir superfluides, c'est-à-dire un fluide de viscosité nulle.
- De même, certains solides subissent une transition de phase à très basse température pour devenir supraconducteurs, c'est-à-dire que leur résistance électrique devient nulle.
- Certains corps purs comme le fer ou le nickel (utilisés pour fabriquer des aimants) sont dits "ferromagnétiques". À partir d'une certaine température, appelée "température de Curie", une transition de phase se produit et le corps pur devient paramagnétique, c'est-à-dire sans aimantation résiduelle.
- Le passage de l'état solide à l'état liquide s'appelle une fusion.
Les différentes transitions de phase correspondant à des changements d'état du corps pur sont nommées et représentées symboliquement ci-dessous.
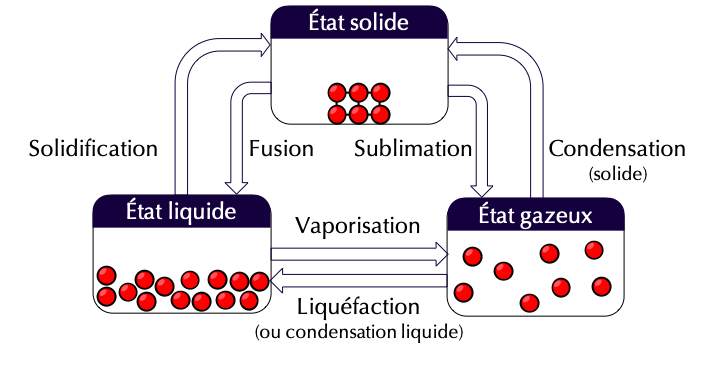
Figure 2 : Les trois états du corps pur et les changements d'état associés.
3.2. Températures de changement d’état
Le changement d'état d'un corps pur se fait à température constante. Cette température est appelée température de changement d'état.
- Pour passer de l'état solide à l'état liquide, un corps pur subit une fusion à la température de fusion de ce corps, notée \(T_{\textrm{fus}}\).
- Pour passer de l'état liquide à l'état gazeux, un corps pur subit une vaporisation. Lorsque la vapeur est localement saturée (à l'interface liquide-gaz) de la même espèce chimique que le liquide, le liquide entre en ébullition à une température bien précise : la température d'ébullition notée \(T_{\textrm{éb}}\).
La glace fond et l'eau gèle à la même température : la température de fusion \(T_{\textrm{fus}}=0\ \mathrm{^{\circ{}}C}\) à pression atmosphérique au niveau de la mer \(p=p_{\textrm{atm}}\).
Pour étudier un changement d'état d'un corps pur, il est possible de relever la température de ce corps en fonction du temps. On obtient ainsi une courbe de température. Un exemple de courbe de température est représenté ci-dessous pour le corps pur "gallium".
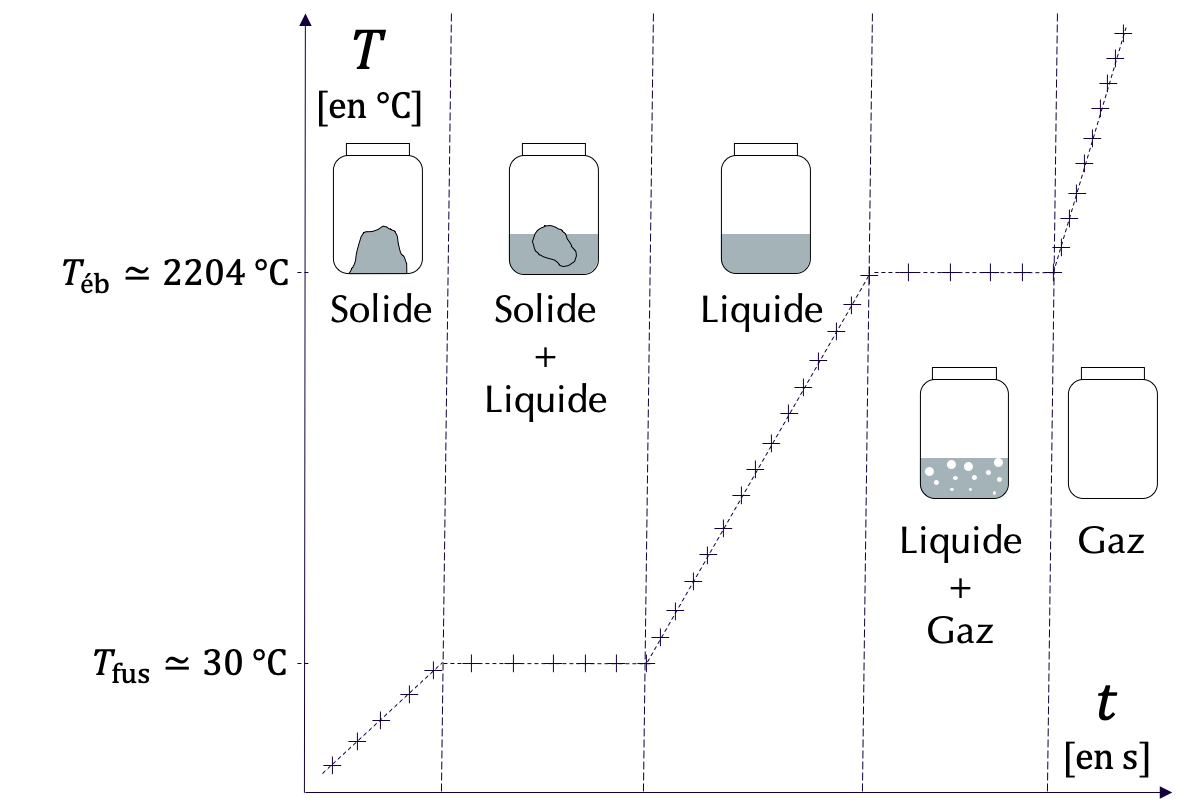
Figure 3 : Courbe de température du gallium.
- Quand le corps pur est sous une seule phase (on dit que le système dans le flacon est monophasé, il est alors présent dans un seul état), sa température évolue librement en fonction de l'énergie thermique qui lui est transférée.
- Quand le corps pur coexiste sous deux phases (on dit que le système dans le flacon est diphasé, il est présent alors dans deux états de façon simultanée), sa température est fixée à la température de changement d'état.